
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
分析 实验室需配制480ml 0.1mol/L的Na2CO3溶液,实验室没有480mL的容量瓶,需要选用500mL容量瓶,实际配制的溶液为500ml 0.1mol/L的Na2CO3溶液,需要溶质碳酸钠的物质的量为0.05mol,溶质的质量为106g/mol×0.05mol=5.3g;若称量带结晶水的碳酸钠,则Na2CO3•10H2O晶体质量为:286g/mol×0.05mol=14.3g.
解答 解:A.实验室没有480mL容量瓶,应该选用500mL容量瓶配制溶液,故A错误;
B.称取5.3 g Na2CO3固体溶于水配成500 mL溶液,溶质的物质的量为0.05mol,溶液体积为0.5L,溶液的浓度为0.1mol/L,故B正确;
C.若用Na2CO3•10H2O晶体溶于水配制成0.5L溶液,需要称量Na2CO3•10H2O的质量为14.3g,故C错误;
D.物质的量浓度中体积为溶液的体积,溶剂水的体积为0.5L,则溶液的体积大于0.5L,故D错误;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,明确物质的量浓度的概念及相关计算公式是解题关键,注意溶剂体积与溶液体积的区别,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2和O3中所含分子数相等 | |
| B. | 常温常压下,14g N2含有质子数为7NA | |
| C. | 标准状况下,22.4L H2含有的原子数为NA | |
| D. | 等质量的CO与CO2中所含碳原子数之比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | NaHSO4=Na ++HSO4- | ||
| C. | NaHCO3=Na++H++CO32- | D. | NH4Cl=NH4++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
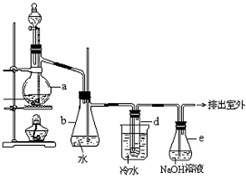 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com