
【题目】如图表示两种晶体的微观结构:
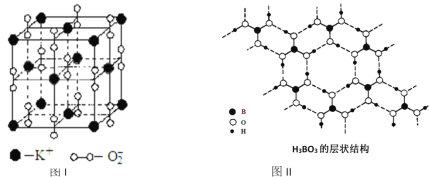
试回答下列有关问题:
(1)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。图I为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则晶体中,与每个K+距离最近的K+有_________个,0价氧原子与-2价氧原子的数目比为_________;
(2)正硼酸(H3BO3)是一种片层结构的白色晶体,层内的H3BO3分子通过氢键相连(如图II)。下列有关说法正确的有_________。
①正硼酸晶体属于原子晶体
②H3BO3分子的稳定性与氢键有关
③在H3BO3分子中各原子未能都满足8e-稳定结构
④含1molH3BO3的晶体中有3mol氢键
⑤含1molH3BO3的晶体中有3mol极性共价键
⑥晶体中每个B与相邻的3个O共平面
【答案】12 3:1 ③④⑥
【解析】
(1)晶体中,与每个K+距离最近的K+个数=3×8÷2=12,;该晶胞中K+个数=8×![]() +6×
+6×![]() =4,O2-个数=1+12×
=4,O2-个数=1+12×![]() =4,设0价氧原子与-2价氧原子个数分别为x、y,根据原子守恒得x+y=2 ,化合价得02y=1 ,解得y=0.5,x=1.5,所以0价氧原子与-2价氧原子的数目比=1.5:0.5=3:1;答案为:12;3:1。
=4,设0价氧原子与-2价氧原子个数分别为x、y,根据原子守恒得x+y=2 ,化合价得02y=1 ,解得y=0.5,x=1.5,所以0价氧原子与-2价氧原子的数目比=1.5:0.5=3:1;答案为:12;3:1。
(2)①正硼酸晶体中存在H3BO3分子,且该晶体中存在氢键,说明硼酸由分子构成,为分子晶体,原子晶体内只有共价键,故①错误;
②分子的稳定性与化学键有关,与氢键无关,氢键影响其熔沸点,故②错误;
③硼原子最外层只有3个电子,与氧原子形成3对共用电子对,所以B原子不是8e-稳定结构,故③正确;
④1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,故④正确;
⑤1mol H3BO3的晶体中有3molB-O键和3molO-H键,则1mol H3BO3的晶体中有6mol极性共价键,故⑤错误;
⑥晶体中与每个“构成粒子”相邻的粒子形成3个氢键,为平面结构,为平面正三角形结构,故⑥正确;答案为③④⑥。


科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是( )
A.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B.雪是冬之精灵,在雪![]() 水
水![]() 冰的转化中能量变化。ΔH1>0,ΔH2<0
冰的转化中能量变化。ΔH1>0,ΔH2<0
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热量就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:

完成下列问题:
(1)该反应的化学方程式为_____________________。
(2)前2 min用A的浓度变化表示的化学反应速率为______________。
在2 min时,图像发生改变的原因可能是________(用字母表示)。
A.增大压强 B.降低温度
C.加入催化剂 D.增加A的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使一定量的A和B气体混合发生反应:2A(g)+3B(g)![]() C(g)。下列描述中,说明反应已经达到平衡状态的是( )
C(g)。下列描述中,说明反应已经达到平衡状态的是( )
A.各物质的浓度之比c(A):c(B):c(C)=2:3:4
B.混合气体中各物质的浓度相等
C.单位时间内,若消耗了2amolA,同时也消耗了amolC
D.混合气体的体积是反应开始前的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是
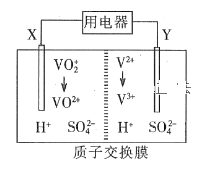
A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5 min反应,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,试求:
(1)x的值是________;
(2)A在5 min时的浓度是___;
(3)5 min 内B的平均反应速率是_____;
(4)A转化率是____;
(5)容器内在5 min时与开始时的压强比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅胶在干燥时因加有氯化钴(![]() )会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成
)会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成![]() 。请回答下列问题:
。请回答下列问题:
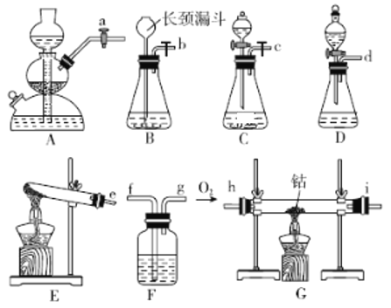
(1)实验①~④是制备氧气的试剂组合,请从A~E中选择最恰当装置符号填入表中。
实验 编号 | ① | ② | ③ | ④ |
试剂 | H2O2 溶液 | H2O2 溶液 | KMnO4 固体 | H2O2溶液 |
催化剂 | MnO2粉末 | FeCl3溶液 | 以Al2O3为载体,混有MnO2的块状物 | |
装置 | ____ | ____ | ______ | ______ |
(2)第一小组负责制备无水CoO,若选用装置C作为氧气的发生装置,则制备CoO完整装置的接口连接顺序为___________,装置C发生反应的化学方程式为_______;
(3)![]() 与
与![]() 类似,可以看作氧化钴(CoO)与氧化高钴(
类似,可以看作氧化钴(CoO)与氧化高钴(![]() )形成的化合物,写出
)形成的化合物,写出![]() 与盐酸反应的化学方程式:________________。
与盐酸反应的化学方程式:________________。
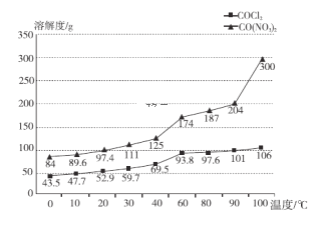
(4)第二小组同学提出另外的方案:用一定质量的钴粉与稀盐酸反应,滴入几滴稀硝酸,将得到的溶液倒入蒸发皿中,加热蒸发浓缩,38~40℃冷却结晶,趁热过滤,得到晶体。根据如图溶解度随温度变化,曲线解释能得到氯化钴晶体的原因:__________。
(5)为了确定晶体的化学式,小组同学把晶体洗涤、干燥、称量得到23.8 g固体,用坩埚加热至质量不再变化,数据如表所示,则该晶体的化学式为________。
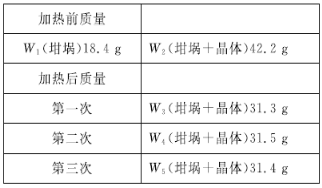
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是( )
H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A. ②③④⑤⑥B. ②⑥⑦⑧⑨
C. ①②⑥⑧D. ②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种重要的消毒剂,俗名灰锰氧。某工厂以废旧的锌锰干电池为原料制备高锰酸钾的流程如下(各部分产物已省略):
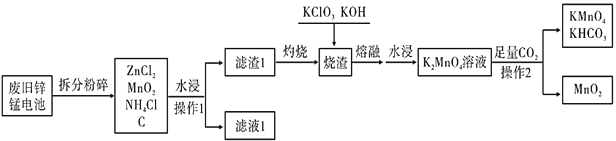
(1)这种锌锰电池放电时,负极的电极反应是_______________________________。
(2)滤渣1灼烧的目的是______________________________;可循环利用的物质是_________________(填化学式)。
(3) “水浸”采用适当加热,搅拌等措施,其目的是_________________________。熔融滤渣可能产生大气污染物是________________(填化学式) 。
(4)向![]() 溶液中通入足量CO2的离子方程式:_______________________。
溶液中通入足量CO2的离子方程式:_______________________。
(5)工业上,以石墨为电极电解K2MnO4溶液制备KMnO4,阳极的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com