
(1)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ•mo1—1、285.8kJ•mo1—1和393.5kJ•mo1—1,则反应C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(2)已知:2H2(g)+O2(g)=2H2O(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
①液态水转化为气态水的热化学方程式为 。
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是 。
(6分)每空2分。
(1)—74.8kJ•mol—1
(2)①H2O(l)=H2O(g) ΔH=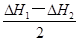
②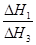
【解析】
试题分析:(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=—890.3kJ•mo1—1,②H2(g)+1/2O2(g)=H2O(l) ΔH=—285.8kJ•mo1—1,③C(s)+O2(g)=CO2(g) ΔH=—393.5kJ•mo1—1,根据盖斯定律,由③+②×2—①可得:C(s)+2H2(g)=CH4(g) ΔH=—74.8kJ•mol—1;(2)根据盖斯定律,由①—②可得:2H2O(l)=2H2O(g) ΔH=ΔH2—ΔH1,则H2O(l)=H2O(g) ΔH=(ΔH2—ΔH1)/2;设CO和H2分别为xmol、ymol,则CO放出热量为—ΔH3×xmol/2,H2放出热量为—ΔH1×ymol/2,因此—ΔH3×xmol/2=—ΔH1×ymol/2,则x/y=ΔH1/ΔH3。
考点:考查燃烧热、热化学方程式、盖斯定律、反应热的计算等相关知识。


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省常州市高二上学期期中考试化学试卷(解析版) 题型:填空题
沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭。
(1)在101kPa时,32gCH4燃烧生成CO2和气态H2O,放出1604kJ的热量,写出甲烷燃烧的热化学方程式为__________________________________________________________。
(2)120℃,取CH4和过量O2的混合气体共0.4mol,点燃使其充分反应,将燃烧后的气体通过足量的碱石灰(NaOH和CaO的固体混合物)充分吸收,碱石灰增重8g。计算:原混合气体中CH4和O2的体积比是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com