
|
设NA表阿伏加德罗常数,N代表粒子数目.下列叙述正确的是 | |
| [ ] | |
A. |
标准状况下2.24 L H2O中,分子数为0.1NA |
B. |
将1 mol Cl2通入到水中,N(HClO)+N(Cl-)+n(ClO-)=2NA |
C. |
常温常压下16 g O2和O3混合气体中.氧原子数为NA |
D. |
7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
科目:高中化学 来源: 题型:阅读理解
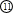 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
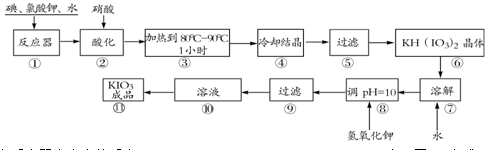
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省锦州市高三检测二(理综)化学部分 题型:填空题
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)

(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。
查看答案和解析>>
科目:高中化学 来源:专项题 题型:实验题
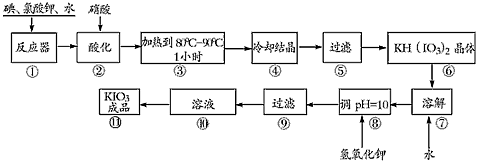
 得到碘酸钾晶体,你建议的方法是__________
得到碘酸钾晶体,你建议的方法是__________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com