
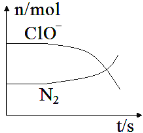
【题目】某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( )
A. 该反应中Cl-为还原产物
B. 氧化剂与还原剂物质的量比为3:2
C. 消耗1 mol还原剂,转移6 mol电子
D. 氧化性:ClO-比 N2强
【答案】C
【解析】
从图示中可以看出,ClO-随反应的进行而减小,应是反应物,N2的量随反应的进行而增加,应是生成物。根据原子守恒、得失电子守恒和电荷守恒可以写出发生反应的离子方程式为:3ClO-+2NH4++2OH-=N2↑+3Cl-+5H2O、
A.该反应中氯元素的化合价从+1价降为-1价,Cl-是还原产物,A项正确;
B.该反应中氧化剂是ClO-,还原剂是NH4+,依离子方程式可以看出其物质的量之比为3:2,B项正确;
C.NH4+是还原剂,每消耗2molNH4+,转移的电子数才为6 mol,C项错误;
D.在该反应中,ClO-是氧化剂,N2是氧化产物,所以氧化性:ClO->N2,D项正确;
所以答案选择C项。


科目:高中化学 来源: 题型:
【题目】以下广告语中,符合科学道理的是( )
A.“超纯净水”绝对卫生,对人有益
B.含碘食盐可以防治甲状腺肿大
C.无糖饼干中不含糖类物质
D.本饮料由纯天然物质配成,绝对不含化学物质,对人无害
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用“甲烷蒸气转化法”生产氢气,反应的热化学方程式为CH4(g)+H2O(g)CO2(g)+3H2(g) △H=+161.1kJ·mol-1
(1)已知温度、压强对甲烷平衡时的体积分数的影响如图1,请回答:
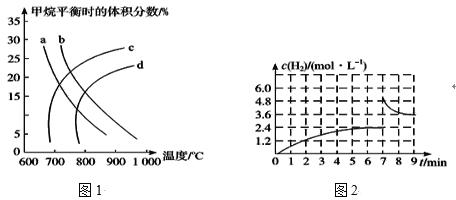
①图1中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷体积分数的曲线,其中表示1MPa的是_____。
②该反应的平衡常数:K(600℃)___(填“>”“<”或“=”)K(700℃)。
(2)①已知:在700℃、1MPa时,1molCH4与1molH2O在1L的密闭容器中反应,6min时达到平衡(如图2),此时CH4的转化率为__,该温度下反应的平衡常数为____(结果保留小数点后一位数字)。
②从图2分析,由第一次平衡到第二次平衡,平衡移动的方向是____(填“向正反应方向”或“向逆反应方向”)移动,采取的措施可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L密闭容器中加人反应物A、B,发生如下反应:A+2B=3C.经2min后,A的浓度从开始时的1.0mol/L降到0.8mol/L.已知反应开始时B的浓度是1.2mol/L.则:2min末B的浓度___________、C的物质的量_________,2min内,用A物质的浓度变化来表示该反应的反应速率,即V(A)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是
A.室温下Na与空气中O2反应制取Na2O2B.Fe在稀硝酸中发生钝化
C.SO2与过量氨水反应生成(NH4)2SO3D.MnO2和稀盐酸反应制取Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们在实验室里用不同的方法分别制取Cu(NO3)2,并在此基础上探究Cu(NO3)2的化学性质。
(1)甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2,反应的化学方程式是___。
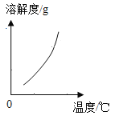
(2)乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、____________、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是_____。
(3)丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)

①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是____________。
②集气瓶中最终收集到的气体颜色是____________,U形管中进入集气瓶后颜色发生变化的原因是___。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是___。
④由该实验可得出的结论是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物 一定条件下能和6molNaOH反应
一定条件下能和6molNaOH反应
D. 分于式为C4H7ClO2,可与NaHCO3溶液反应产生CO2的有机物可能结构有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
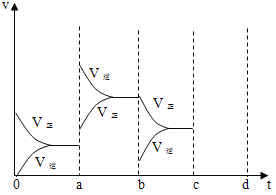
【题目】(1)下图表示在密闭容器中反应:2SO2+O2 ![]() 2SO3 △H =-Q kJ/mol 到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是_____;b→c 过程中改变的条件可能是_____; 若增大压强时,将反应速度变化情况画在 c~d 处____________。
2SO3 △H =-Q kJ/mol 到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是_____;b→c 过程中改变的条件可能是_____; 若增大压强时,将反应速度变化情况画在 c~d 处____________。
(2)可逆反应 mA(g)+nB(g)![]() pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
①用“>”、“=”或“<”填空:该反应的Δ H_____0,m+n_____p。
②用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入 B,则 A 的转化率_____;升高温度,则平衡时 B、C 的浓度之比 c(B)/c(C)将_____;加入催化剂,平衡时气体混合物的总物质的量_____。
③若 A、C 均为无色气体,B 为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入 C,平衡混合物的颜色_____;而恒压充入氖气,平衡混合物颜色_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com