
分析 NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性,Na2CO3水解程度较大,溶液碱性较强;
(1)加入氯化钙溶液后,如生成沉淀,说明乙同学结论正确,若不产生沉淀,说明甲正确;
(2)将加热后的溶液冷却到20℃,若溶液的PH大于8.4,说明碳酸氢钠分解;
(3)常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
解答 解:NaHCO3为强碱弱酸盐,在溶液中发生:HCO3-+H2O?H2CO3+OH-,水解呈碱性;Na2CO3水解程度较大,溶液碱性较强,
(1)加入氯化钙溶液后,如生成沉淀,说明溶液中存在大量的CO32-,温度升高造成NaHCO3受热生成Na2CO3,乙同学结论正确,反之甲正确;而加入B、D,由于氢氧根与碳酸氢根反应生成碳酸根,一定生成沉淀,不能说明温度升高是否导致NaHCO3分解;加入C无现象,
故答案为:A;不产生沉淀;
(2)由于NaHCO3饱和溶液在20℃时pH是8.4,将加热后的溶液冷却到20℃,若溶液的PH大于8.4,说明碳酸氢钠分解产生了水解程度更大的碳酸钠,则乙正确,
故答案为:大于;
(3)如NaHCO3的分解温度为150℃,则乙的结论肯定错误,原因是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,
故答案为:乙.
点评 本题考查较为综合,涉及盐类的水解和实验方案的评价,侧重于学生的实验能力和评价能力的考查,注意把握盐类水解的原理和规律,把握物质的性质,难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:推断题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在常温常压下是气体,能使溴的四氯化碳溶液褪色 | |
| B. | 苯可做有机溶剂,能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇和乙烷都能发生取代反应 | |
| D. | 乙酸乙酯在酸性条件下可以水解生成乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的水溶液中:Fe2+、K+、Ca2+、Br- | |
| B. | pH=0的溶液中:Cu2+、Cl-、SO${\;}_{4}^{2-}$、Na+ | |
| C. | 含大量NO3-的溶液:Fe3+、Al3+、SO32-、H+ | |
| D. | 能够与金属Al常温下反应放出气体的溶液:HCO${\;}_{3}^{-}$、Na+、Ca2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式可以表示为CH2CH2 | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 丙烯所有原子可能在一个平面上 | |
| D. | 水煤气和天然气的主要成分都是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
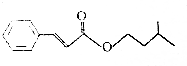
| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 能与新制的碱性Cu(OH)2悬浊液共热生成红色沉淀 | |
| C. | 能与FeCl3溶液反应显紫色 | |
| D. | 能与热的浓硝酸和浓硫酸混合液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油经分馏可获得含碳原子少的轻质油 | |
| B. | ①主要发生物理变化 | |
| C. | ②是石油的裂化、裂解 | |
| D. | ③属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①⑤⑥ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com