
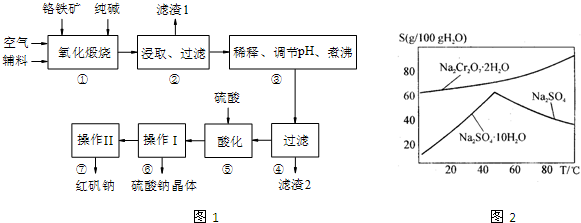
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
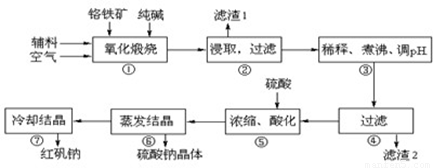
中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应: SiO2+Na2CO3 Na2SiO3+CO2↑
Al2O3+Na2CO3
Na2SiO3+CO2↑
Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
|
完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ;
(2)“③”中调节pH至4.7,目的是 ;
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: ;
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是: 。
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度 (设整个过程中其它杂质不参与反应) 。
(1)使反应物接触更充分,加快反应速率;
(2)除去溶液中的AlO2-、SiO32-
(3)2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)①当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色 ②83.84%
【解析】
试题分析: (1)反应①反应时不断搅拌目的是加快反应速率。
(2)氧化煅烧后过滤,滤液中阴离子主要含有CrO42-、AlO2-、SiO32-,由表格中信息可知,调节pH至4.7目的是除去溶液中AlO2-、SiO32-。
(3)CrO42-与H+生成Cr2O72-和水。
(4)发生的反应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-,Cr2O72-~3I2~6S2O32-,所以Na2Cr2O7纯度为= 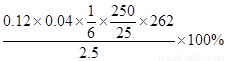 =83.84%。淀粉遇碘显蓝色,加入硫代硫酸钠溶液将碘反应完全后溶液呈无色,所以当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色变为无色且30s不变色为终点。
=83.84%。淀粉遇碘显蓝色,加入硫代硫酸钠溶液将碘反应完全后溶液呈无色,所以当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色变为无色且30s不变色为终点。
考点: 化工生产流程图的分析 离子方程式 化学计算 化学实验


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
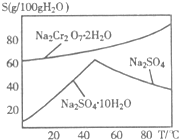 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
| ||
. |
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
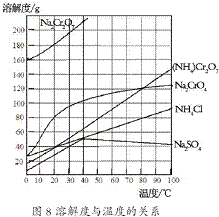 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、反应①和②均为氧化还原反应 |
| B、反应①的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性大于Fe3O3小于NaCrO4. |
| D、生成1mol的Na2Cr2O7时整个反应过程共转移6mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com