
| A. | 因为NH3的水溶液可以导电,所以NH3是电解质 | |
| B. | 因为O2可以与CO反应生成CO2,所以可以用O2除去CO2中的杂质CO | |
| C. | 因为液态HCl不导电,所以HCl是非电解质 | |
| D. | 因为氢氧化铁胶体具有吸附性,所以常用于净水 |
分析 A.电解质必须是本身能够电离产生自由移动离子;
B.CO的浓度太小,不能与氧气反应生成二氧化碳;
C.溶于水或者熔融状态下能导电的化合物是电解质;
D.氢氧化铁胶体具有吸附性,能够吸收水中固体杂质颗粒.
解答 解:A.氨水导电,一水合氨为电解质,氨气本身不能电离,所以氨气为非电解质,故A错误;
B.CO的浓度太小,不能与氧气反应生成二氧化碳,所以不能用O2除去CO2中的杂质CO,可以通过灼热的铜网,故B错误;
C.氯化氢在水中能电离产生氢离子和氯离子,是电解质,故C错误;
D.氢氧化铁胶体具有吸附性,能够吸收水中固体杂质颗粒,可以用来净水,故D正确;
故选:D.
点评 本题考查了电解质判断,物质的除杂,胶体的用途,明确电解质概念,熟悉相关物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
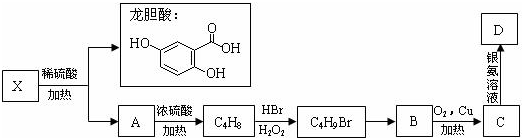
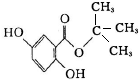
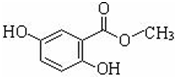 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称是 2,5,5-三甲基-3-乙基庚烷 的名称是 2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将 与NaOH的醇溶液共热可制备 CH3-CH═CH2 与NaOH的醇溶液共热可制备 CH3-CH═CH2 | |
| C. | 向柠檬醛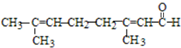 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | ||
| C. | ${\;}_{2}^{3}$He原子核内含有3 个中子 | D. | ${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | N2 | C. | NO | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
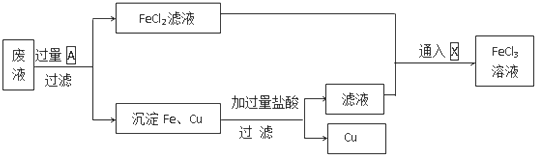
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com