
| A. | X分子中含有酯基和醛基 | |
| B. | X和Y相对分子质量之差为120 | |
| C. | X分子中有6个O原子,且水溶液显酸性 | |
| D. | Y分子可能结构有6种 |
分析 1molX水解得到1molY和2mol醋酸,则X为酯,Y中含有羟基,且Y分子中至少含有2个O原子,
Y分子中C、H两种元素总质量分数为65.2%,1-65.2%=34.8%,
当含有2个O原子时,Y的相对分子质量为:$\frac{16×2}{34.8%}$≈92<100不符合;
当含有3个O原子时,Y的相对原子质量为:$\frac{16×3}{34.8%}$≈138,不符合;
当含有4个O原子时,Y的相对原子质量为:$\frac{16×4}{34.8%}$≈183>150,不符合,
所以Y的相对分子质量为138,Y分子中含有C、H的总原子量为:138-16×3=90,
根据商余法可知:$\frac{90}{14}$=6…6>2,所以Y分子中应该含有7个C,含有H原子数为:$\frac{90-12×7}{1}$=6,
所以Y的分子式为:C7H6O3,以此解答该题.
解答 解:1molX水解得到1molY和2mol醋酸,则X为酯,Y中含有羟基,且Y分子中至少含有2个O原子,
Y分子中C、H两种元素总质量分数为65.2%,1-65.2%=34.8%,
当含有2个O原子时,Y的相对分子质量为:$\frac{16×2}{34.8%}$≈92<100不符合;
当含有3个O原子时,Y的相对原子质量为:$\frac{16×3}{34.8%}$≈138,不符合;
当含有4个O原子时,Y的相对原子质量为:$\frac{16×4}{34.8%}$≈183>150,不符合,
所以Y的相对分子质量为138,Y分子中含有C、H的总原子量为:138-16×3=90,
根据商余法可知:$\frac{90}{14}$=6…6>2,所以Y分子中应该含有7个C,含有H原子数为:$\frac{90-12×7}{1}$=6,
所以Y的分子式为:C7H6O3,
A.X溶液能发生银镜反应,说明含有醛基,1molX水解得到1molY和2mol醋酸,则含有酯基,故A正确;
B.1molX与2mol水发生水解反应得到1molY和2mol醋酸,则X、Y相对分子质量之差=2个醋酸的分子量-2个水的分子量=84,故B错误;
C.1molX水解得到1molY和2mol醋酸,Y的分子式为:C7H6O3,则有X+2H2O→C7H6O3+2CH3COOH,由O原子质量守恒可知X分子中有5个O原子,故C错误;
D.Y含有2个羟基、1个醛基,两个羟基有邻、间、对3种位置,另有1个醛基,羟基相邻时有2种,相对时有1种,相间时有3种,对应的同分异构体有6种,故D正确.
故选AD.
点评 本题考查有机物的结构和性质,为高频常见题型,侧重于学生的分析能力的考查,注意把握有机物官能团的性质,为解答该类题目的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
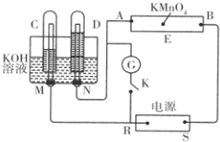 现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.
现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| B. | 醋酸溶液显酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| C. | 向碘化亚铁溶液中通入足量的溴水:2 Br2+2Fe2++2I-═4Br-+2Fe3++I2 | |
| D. | 向碳酸氢钙溶液中滴加过量的烧碱溶液:HCO3-+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷、乙烯 | B. | 乙烯、乙炔 | C. | 氯乙烯、溴乙烯 | D. | 苯、2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
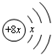 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A. | 对应氢化物的沸点:R>Z>X | |
| B. | Y、Z形成的化合物中只有离子键 | |
| C. | 离子半径:X>Z>Y | |
| D. | Z与X、Y与R形成化合物的晶体类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com