
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是

A. 原混合酸中HNO3的物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+ == 3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
【答案】A
【解析】试题分析:由图像可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑。A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以n(NO3-)=n(Fe)=5.6g÷56g/mol=0.1mol,因为溶液分为两部分,所以原来溶液中n(NO3-)=0.1mol×2=0.2mol,A错误; B、由图像可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;C、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,C正确;D、反应消耗14g铁,即0.25mol铁,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是0.25mol÷0.1L==2.5mol/L,D正确;答案选A。


科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A.氯水与足量的 FeBr2溶液反应:2Fe2++4Br﹣+3Cl2=2Fe3++2Br2+6Cl﹣
B.NaHCO3溶液与 NaOH溶液反应:HCO ![]() +OH﹣=CO
+OH﹣=CO ![]() +H2O
+H2O
C.NaHCO3溶液与盐酸反应:CO ![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.NaHCO3溶液与CaCl2;溶液反应:CO ![]() +Ca2+=CaCO3↓
+Ca2+=CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空:
(1)在标准状况下,下列物质:①4gH2、②11.2LO2、③1molH2O中,所含分子数最多的是 , (填序号,下同),含原子数最多的是 , 质量最大的是 , 体积最小的是 .
(2)在一定的温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积化合物,则该化合物的化学式是;
(3)19g某二价金属的氯化物ACl2中含有0.4molCl﹣离子,ACl2的相对分子质量是 , A2+的摩尔质量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)下列说法不正确的是:
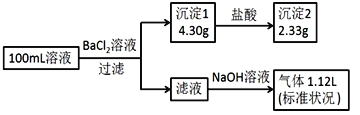
A. 原溶液一定存在CO32-、SO42-、NH4+
B. 原溶液一定存在Cl-,一定不存在Fe3+
C. 可能存在Na+,可以通过焰色反应证明其是否存在
D. 若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A. 前2 min,D的平均反应速率为0.2 mol·L-1·min-1 B. 此时,B的平衡转化率是40%
C. 升高该体系的温度,化学平衡常数不变 D. 增加C,逆向速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“长征二号F”运载火箭发射现场.可以看到从火箭的下部喷射出大量的红棕色的气体,关于这种红棕色气体的认识正确的是
A.是溴蒸气,火箭发射时作氧化剂
B.是二氧化氮气体,火箭发射时作还原剂
C.是溴蒸气,火箭发射时作还原剂
D.是二氧化氮气体,火箭发射时作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)室温下,0.1 mol/L的下列溶液中,①NH4Al(SO4)2 ②NH4HSO4 ③HCl ④(NH4)2SO4 ⑤NH4Cl ⑥NH4HCO3 ,pH由大到小的顺序为__________(填写序号)
(2)加热,逐渐蒸干FeSO4溶液,得到的物质为___________。(填化学式)
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图象。

①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是_____(填写罗马数字)
②25 ℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )-c(
)-c(![]() )-3c(Al3+)=____(填数值)。
)-3c(Al3+)=____(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是____;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料。氨气分解反应的热化学方程式如下:2NH3(g) ![]() N2 (g) + 3H2(g) ΔH = + a kJ·mol-1 (a>0)。请回答下列问题:
N2 (g) + 3H2(g) ΔH = + a kJ·mol-1 (a>0)。请回答下列问题:
已知:2H2 (g) + O2 (g) =2H2O(l) ΔH1 = - b kJ·mol-1
NH3 (g) ![]() NH3(l) ΔH2 = - c kJ·mol-1
NH3(l) ΔH2 = - c kJ·mol-1
(1)氨气自发分解的反应条件为________(填“高温”、“ 低温”、“ 任何条件下”),4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(l) 的 ΔH3 =_____________kJ·mol-1。
(2)H2O的电子式为_____________,水能发生电离:2H2O(l) ![]() H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式____________________________________。
H3O++OH-,液氨也能发生类似的电离。请写出液氨的电离方程式____________________________________。
(3)液氨气化后,分解产生的氢气可作为氢氧燃料电池的燃料,在KOH电解质溶液中,电池负极的电极反应为__________________________________________,实验室中用氢氧燃料电池作为电源采用Pt电极对液氨进行电解可以得到H2和N2 ,若电解过程中阳极收集得到4.48L气体(标况),则转移的电子的数目是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示: 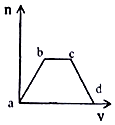
(1)ab段发生的离子反应方程式为 .
(2)bc段依次发生两个离子反应,首先是 , 其次是 .
(3)cd段发生的离子反应方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com