
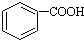
 >H2CO3>
>H2CO3>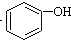 ,将
,将 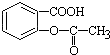 转变为
转变为 的方法是( )
的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| C. | 加热溶液,通入足量的CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaHCO3溶液 |
分析 将 转变为
转变为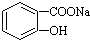 ,可先发生碱性条件的水解,再由酸性的强弱可知,水解产物中通入足量的CO2即可,以此解答.
,可先发生碱性条件的水解,再由酸性的强弱可知,水解产物中通入足量的CO2即可,以此解答.
解答 解:A.与足量的NaOH溶液共热,生成羧酸钠和酚钠结构,因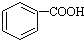 >H2CO3>
>H2CO3>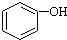 ,则再通入足量的CO2生成邻羟基苯甲酸钠,故A正确;
,则再通入足量的CO2生成邻羟基苯甲酸钠,故A正确;
B.与稀H2SO4共热后,生成邻羟基苯甲酸,再加入足量的NaOH溶液,生成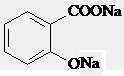 ,故B错误;
,故B错误;
C.加热溶液,通入足量的CO2,不发生反应,故C错误;
D.与稀H2SO4共热后,生成邻羟基苯甲酸,加入足量的NaHCO3溶液,只有-COOH反应生成羧酸钠和酚结构,生成 ,故D正确;
,故D正确;
故选AD.
点评 本题考查有机物的结构和性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、酯性质的考查,注意酸性的比较及强酸制取弱酸的反应原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-445kJ/mol | |
| D. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 化学方程式或结论 |
| 金属Na长时间放置在空气中 | 银白色的金属光泽消失,迅速变暗,有水珠生成,最终生成白色的粉末 | ①4Na+O2═2Na2O Na2O+H2O═2NaOH 2Na+2H2O═2NaOH+H2↑ 2NaOH+CO2═Na2CO3+H2O |
| 将一块Na置于石棉网上,点燃酒精灯加热 | 钠先熔成小球,剧烈燃烧并发出黄色的火焰,生成②淡黄色色的粉末 | 2Na+O2 ═Na2O2 |
| 往上述生成的 Na2O2上滴加蒸馏水 | 生成的气体能使带火星的木条复燃 | 该气体为③O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com