
分析 从“反应速率太快,难于控制和收集.但反应速率可以通过改变反应条件来控制”得出:只要让反应慢下来即可解决.
解答 解:由于纯碱与盐酸充分接触,化学反应速率即较快,故可以采取将纯碱溶解生成溶液,然后滴加盐酸的方法,依据原理是:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2+↑+H2O,所需仪器是:烧杯、玻璃棒、锥形瓶(或圆底烧瓶)、双孔塞、分液漏斗,实验步骤是:溶解纯碱,在锥形瓶中注入适量的纯碱溶液,上塞双孔塞,一孔插入分液漏斗,一孔插入导气管,实验室时,可通过分液漏斗调节注入稀盐酸的量,从而达到控制反应的目的,
答:溶解纯碱,在锥形瓶中注入适量的纯碱溶液,上塞双孔塞,一孔插入分液漏斗,一孔插入导气管,实验室时,可通过分液漏斗调节注入稀盐酸的量,观察气体生成,从而达到控制反应的目的.
点评 本题主要考查的是实验室中常见气体的制备以及实验方案的设计,有一定难度,把纯碱变为溶液使用,熟练灵活利用酸与盐的反应原理是解决本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 通过品红溶液 | |
| B. | 通过澄清石灰水 | |
| C. | 先通过高锰酸钾溶液,再通过澄清石灰水 | |
| D. | 先通过澄清石灰水,再通过高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
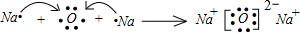
 或
或

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2和H2O2 | B. | KOH和H2SO4 | C. | CCl4和KCl | D. | MgCl2和Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
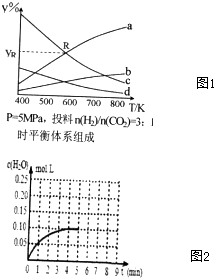 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
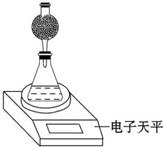 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com