
| 元素 | 相关信息 |
| X | 地壳中含量最多的金属,其氧化物可用作耐火材料 |
| Y | 单质在常温常压下为黄绿色气体 |
| Z | 常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
| U | 常温下单质遇浓硫酸钝化,其一种核素的质量数为56,中子数为30 |
| V | 属短周期元素,原子的最外层电子数是内层电子数的2/5 |
 U3++3H2O的平衡常数K= 。
U3++3H2O的平衡常数K= 。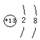 (3分,每空1分)
(3分,每空1分) Fe3++3H2O,固体和纯液体不能写入平衡常数表达式,则该反应的平衡常数K=c(Fe3+)/c3(H+)=[c(Fe3+)?c3(OH-)]/[c3(H+)?c3(OH-)]= Ksp[Fe(OH)3]/Kw3=2.63×10-39/(1.0×10-14) 3=2.63×103。
Fe3++3H2O,固体和纯液体不能写入平衡常数表达式,则该反应的平衡常数K=c(Fe3+)/c3(H+)=[c(Fe3+)?c3(OH-)]/[c3(H+)?c3(OH-)]= Ksp[Fe(OH)3]/Kw3=2.63×10-39/(1.0×10-14) 3=2.63×103。

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:不详 题型:单选题
| A.Y2—的还原性较Z—强 |
| B.Y的氢化物与X2Y所含化学键的类型相同 |
| C.YO2与Z2均可作为漂白剂,但起漂白作用的原理不同 |
| D.以石墨为电极电解XZ的水溶液,在阴极附近滴入酚酞可观察到溶液显红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:X>Y>Z | B.非金属性:X>Y>Z |
| C.气态氢化物稳定性:X>Y>Z | D.酸性:HXO4>H2YO4>H3ZO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气态氢化物的稳定性按X、Y、Z的顺序递减 |
| B.三种元素的含氧酸酸性:H4ZO4 > H3YO4> H2XO4 |
| C.元素的最高正价按X、Y、Z的顺序递减 |
| D.元素原子的半径按X、Y、Z的顺序递减 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X分别和其它四种元素均可形成至少2种化合物 |
| B.M分别和W、X、Y、Z形成化合物,均显相同化合价 |
| C.M、X、Z三种元素组成的化合物含有离子键 |
| D.M、X、Y组成化合物和Y、Z组成化合物,其水溶液均呈碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| B.第IA族元素又称碱金属,其单质都可以和水反应生成对应的碱 |
| C.若两种元素原子的最外层电子数相同,则两元素的最高正价一定相同 |
| D.第三周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com