
| A. | 氧化钙溶于水 | B. | 铁粉溶于稀硫酸 | ||
| C. | 盐酸与氢氧化钠反应 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
分析 生成物总能量高于反应物总能量的反应属于吸热反应,根据常见的放热反应和吸热反应进行判断.若反应物的总能量大于生成物的总能量则为放热反应.
常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应、绝大多数化合反应,铝热反应;
常见的吸热反应有:个别的化合反应(如C和CO2)、绝大数分解反应、少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:生成物总能量高于反应物总能量的反应属于吸热反应,
A、氧化钙溶于水的反应是放热反应,故A错误;
B、铁粉溶于稀硫酸的反应是放热反应,故B错误;
C、盐酸与氢氧化钠反应的反应是放热反应,故C错误;
D、氢氧化钡晶体与氯化铵晶体混合的反应是吸热反应,故D正确;
故选D.
点评 本题主要考查了放热反应和放热反应,题目难度不大,掌握常见的放热反应和放热反应是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的该溶液中含有0.2NA个SO42- | |
| B. | 该溶液中Cu2+、H+、NO3-可以大量共存 | |
| C. | 滴入Ba(OH)2溶液恰好使SO42-完全沉淀的离子方程式为:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 该溶液加热蒸干后得到Al2O3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用于制造红色油漆和涂料 | B. | 水玻璃可用作木材的防火剂 | ||
| C. | 铝制容器可用于盛装稀硫酸 | D. | 碘化银可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、K+、SO42ˉ、NO3ˉ | B. | Mg2+、NH4+、SO42-、Clˉ | ||
| C. | Na+、K+、SO42ˉ、NO3ˉ | D. | Ba2+、Na+、CO32-、NO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
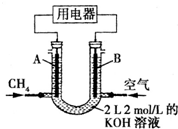 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com