
| A. |  | B. |  | C. |  | D. |  |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
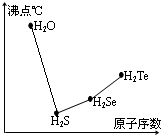 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.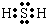 .在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.
.在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Fe2O3是还原剂 | |
| B. | Fe2O3可以通过铁丝在氧气中燃烧制得 | |
| C. | 3molNa2O2反应,有3mol电子转移 | |
| D. | 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
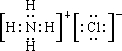 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度 | |
| B. | 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L-1下降到0.03 mol•L-1,该双氧水在这2h中分解的平均反应速率约为0.015 mol•L-1•h-1 | |
| C. | 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢 | |
| D. | 一定条件下,固定体积的容器中发生反应A(g)+B(g)?2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应一定处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| B. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| C. | 一定条件下,氨基酸之间能发生反应,合成更复杂的化合物(多肽) | |
| D. | 向2ml苯中加入1ml酸性高锰酸钾溶液,振荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com