
NA为阿伏加德罗常数,下列叙述中错误的是( )
|
| A. | 1mol Al3+含有的核外电子数为10NA |
|
| B. | 1mol Na与足量O2反应,无论生成Na2O或Na2O2均失去NA个电子 |
|
| C. | 标准状况下,2.24L乙醇中所含分子数约为0.1NA |
|
| D. | 1L 0.1mol/L的盐酸中,含0.1NA个Cl﹣ |
| 阿伏加德罗常数. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A、Al3+的核外有10个电子; B、根据反应后钠元素的价态来分析; C、标况下,乙醇为液态; D、求出HCl的物质的量,然后根据HCl是强电解质,完全电离来分析. |
| 解答: | 解:A、Al3+的核外有10个电子,故1molAl3+的核外有10mol电子,个数为10NA个,故A正确; B、反应后无论产物是哪种,钠元素的价态均变为+1价,故1mol钠均失去1mol电子,故B正确; C、标况下,乙醇为液态,故C错误; D、溶液中HCl的物质的量n=CV=0.1mol/L×1L=0.1mol,由于HCl是强电解质,在溶液中完全电离,故0.1molHCl电离出0.1mol氯离子,故D正确. 故选C. |
| 点评: | 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大. |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
某酸式盐NaHY的水溶液显碱性,下列叙述正确的是
( )
A.H2Y的电离方程式:H2Y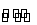 2H++Y2-
2H++Y2-
B.HY-的水解方程式:HY-+H2O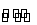 H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+]
D.该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究温度、硫酸铜对锌与稀硫酸反应速率的影响规律,某同学设计如下方案:
| 编号 | 纯锌粉质量 | 0.2 mol·L-1硫酸体积 | 温度 | 硫酸铜固体质量 |
| Ⅰ | 2.0 g | 10.0 mL | 25℃ | 0 |
| Ⅱ | 2.0 g | 10.0 mL | t℃ | 0 |
| Ⅲ | 2.0 g | 10.0 mL | 35℃ | 0.2 g |
| Ⅳ | 2.0 g | 10.0 mL | 35℃ | 4.0 g |
下列推断合理的是( )
A.为了选择Ⅱ和Ⅲ实验探究硫酸铜对反应速率的影响,必须控制t=25
B.待测物理量是收集等体积(相同条件)气体所需要的时间,时间越长,反应越快
C.根据该方案,还可以探究硫酸浓度对反应速率的影响
D.根据该实验方案得出反应速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ
查看答案和解析>>
科目:高中化学 来源: 题型:
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
|
| A. | 相同温度下,等浓度的Na2CO3和NaHCO3溶液的pH,Na2CO3更大 |
|
| B. | 常温时,Na2CO3的溶解度大于NaHCO3 |
|
| C. | 在酒精灯加热条件下,前者不分解,后者分解 |
|
| D. | 加入澄清石灰水,前者产生沉淀,后者不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某酸性溶液中含有Ba2+、Fe3+,则下列能与上述离子共存的离子组是( )
|
| A. | CO32﹣、SO42﹣、NH4+、Na+ | B. | Cl﹣、SCN﹣、NO3﹣、Cu2+ |
|
| C. | Br﹣、I﹣、Mg2+、Na+ | D. | H+、Cl﹣、NO3﹣、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
从实验室加热氯酸钾与MnO2的混合物制氧气后的剩余物质中回收MnO2的操作顺序正确的是( )
|
| A. | 溶解、过滤、蒸发结晶、洗涤 | B. | 溶解、过滤、洗涤、干燥 |
|
| C. | 溶解、蒸发结晶、洗涤、过滤 | D. | 溶解、洗涤、过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲研究SO2的性质.
(1)将相关的含硫物质分为如表所示3组,则第2组中物质X的化学式是 H2SO3 .
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)实验室制取SO2的化学方程式为 .
(3)利用下图所示的装置研究SO2的性质:(熔点:SO2﹣76.1℃,SO3 16.8℃,沸点:SO2﹣10℃,SO3 45℃).
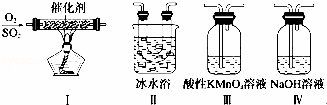
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 .
②甲同学按Ⅰ、Ⅱ、III、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ; 装置Ⅲ中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是 .
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40mL 2.5mol•L﹣1 NaOH溶液,反应后增重4.8g,则产物(水除外)的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
烃分子中若含有双键、三键或环,其碳原子所结合的氢原子数则少于碳原子数对应烷烃所含有的氢原子数,亦具有一定的不饱和度(用Ω表示).下表列出几种烃的不饱和度:
| 有机物 | 乙烯 | 乙炔 | 环己烷 | 苯 |
| Ω | 1 | 2 | 1 | 4 |
据此下列说法不正确的是( )
|
| A. | 1molΩ=3的不饱和链烃再结合3mol H2,即达到饱和 |
|
| B. |
|
|
| C. | C4H8的不饱和度与C3H6、C2H4的不饱和度不一定相同 |
|
| D. | CH3CH2CH=CH2与环丁烷的不饱和度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.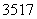 Cl与
Cl与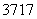 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com