
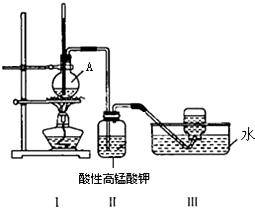
 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:分析 (1)乙醇发生消去反应生成乙烯,浓硫酸作催化剂、吸水剂;
(2)乙醇发生消去反应生成乙烯和水;
(3)同时有刺激性气味气体产生,为二氧化硫,具有漂白性,浓硫酸与C发生氧化还原反应生成二氧化硫;
(4)乙醇、乙烯均能被高锰酸钾氧化.
解答 解:(1)浓硫酸在反应中的作用为催化剂、吸水剂,故答案为:催化剂、吸水剂;
(2)A中发生反应的化学反应方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(3)反应过程中因温度过高反应液变黑,同时有刺激性气味气体产生,为验证该气体可用品红溶液,用化学方程式解释产生该气体的原因C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:品红溶液;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)一段时间后,发现装置(II)中硫酸酸化的高锰酸钾溶液褪色.甲同学认为该现象一定能证明乙烯被酸性高锰酸钾溶液氧化了,不同意的他的观点,乙醇易挥发,原因是乙醇、乙烯均能被高锰酸钾氧化,故答案为:否;乙醇、乙烯均能被高锰酸钾氧化.
点评 本题考查有机物的制备实验及性质实验,为高频考点,把握反应原理、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,综合性较强,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低碳生活注重节能减排,减少温室气体的排放 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com