
下图为10 mL一定物质的量浓度的HCl溶液用一定物质的量浓度的NaOH溶液滴定的图示。请根据图示计算:
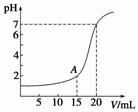
(1)氢氧化钠溶液物质的量浓度是多少?
(2)A点时溶液的pH是多少?
(1)0.05 mol·L-1 (2)2
解析 (1)根据题给图象可以看出,在氢氧化钠的体积为0时,盐酸溶液的pH=1,故可求出盐酸溶液的物质的量浓度为0.1 mol·L-1;再根据pH=7时,用去氢氧化钠溶液的体积为20 mL,此时盐酸与氢氧化钠恰好完全反应,则有0.01 L×0.1 mol·L-1=0.02 L×[NaOH],即[NaOH]=0.05 mol·L-1。
(2)A点时,显然盐酸是过量的,则加入的氢氧化钠与盐酸反应后剩余的盐酸为0.01 L×0.1 mol·L-1-0.015 L×0.05 mol·L-1=0.000 25 mol,此时,溶液的总体积为0.01 L+0.015 L=0.025 L,所以A点时溶液中的H+浓度为[H+]=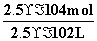 =1×10-2 mol·L-1,所以pH=2。
=1×10-2 mol·L-1,所以pH=2。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.碳酸钙与盐酸反应:CO32-+2H+===H2O+CO2↑
B.硫酸氢钠溶液中加入足量的烧碱溶液:HSO4-+OH-=== SO42-+H2O
C.过氧化钠与水反应:2O22-+2H2O===4OH- + O2↑
D.澄清石灰 水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定显酸性的是( )
A.溶液中[OH-]>[H+]
B.滴加紫色石蕊试液后变红色的溶液
C.溶液中[H+]=10-6 mol·L-1
D.pH<7的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.HCl溶液中无OH-
B.NaOH溶液中无H+
C.KCl溶液中既无H+也无OH-
D.常温下,任何物质的水溶液中都有H+和OH-,且KW=1×10-14 mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Al3+、NH 的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是 ( )
的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是 ( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH D.Fe3+
D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
A—E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
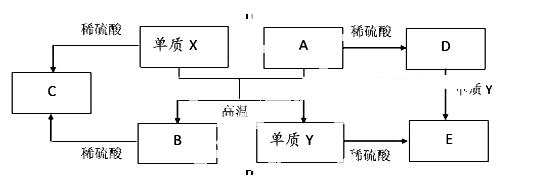
则下列说法正确的是( )
A.X与A反应的化学方程式是: Al2O3 + 2Fe  Fe2O3 + 2Al
Fe2O3 + 2Al
B.向D溶液中滴加KSCN溶液,产生血红色沉淀
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1mol•L﹣1的盐酸的体积为( )
A. 0.05 L B. 0.1 L C. 0.2 L D. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同温度下,0.01 mol·L-1 NaOH溶液和0.01 mol·L-1的盐酸相比,下列说法正确的是( )
A.由水电离出的[H+]相等
B.由水电离出的[H+]都是1.0×10-12 mol·L-1
C.由水电离出的[OH-]都是0.01 mol·L-1
D.两者都促进了水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com