
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I- =Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D. 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
做以下实验可证明氨基乙酸晶体中,同时存在羧基和氨基,请填空。
(1)在一支试管中加入2 mL蒸馏水,再加入1滴极稀的烧碱溶液,在此溶液中加入两滴酚酞试液,此时溶液稍显粉红色,然后加入一小粒氨基乙酸晶体,溶液的粉红色褪去。说明氨基乙酸分子中有________基,显示出了________性,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)同样在盛有蒸馏水的试管中加入紫色石蕊试液及一滴稀盐酸,使溶液稍显红色,然后加入一小粒氨基乙酸晶体,溶液由红色转变为紫色,说明氨基乙酸分子中有________基,显示出了________性,反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
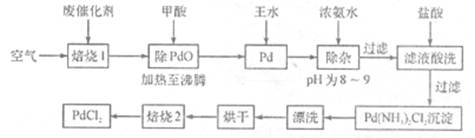
(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:___ 。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 (写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是:
。
(5)“焙烧2”的目的是: 。
(6)与焙烧2产生的气体组成元素相同的化合物是 ,该物质与空气形成一种环保型碱性燃料电池,其负极反应式为
(7) Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 molFe2-被足量的H2O2溶液氧化,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A、3个 B、4个 C、5个 D、全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 B、C、D、E五种短周期元素,元素A最外层电子数与其周期数相等,A与C可形成A2C2和A2C两种化合物,B的最高价氧化物对应的水化物与气体BA3化合生成乙,D+与C2-具有相同的电子数,E元素最高化合价与最低化合价代数和为6。
请回答下列问题:
(1) C在元素周期表中的位置为____________。写出BA3的电子式_______________。
(2)上述元素中,原子半径最大的是____________________(写元素符号)。最高价氧化物对应的水化物中酸性最强的酸是__________________(写化学式)。
(3)化合物乙的水溶液呈酸性,请用离子方程式表示__________________。
(4) A、C、E三种元素按原子个数比1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN-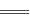 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图的转化关系判断下列说法正确的是(反应条件已略去)
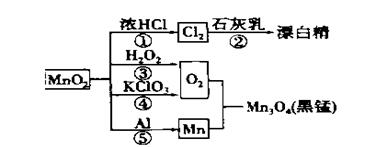
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
将有机物完全燃烧,生成CO2和H2O。将12 g该有机物完全燃烧后的产物通过浓H2SO4,浓H2SO4增重14.4 g,再通过碱石灰,碱石灰增重26.4 g。该有机物分子式为( )
A.C4H10 B.C2H6O
C.C3H8O D.C2H4O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com