
【题目】氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是_____________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______________________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是___________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作③。
①55℃蒸发结晶; ②趁热过滤; ③___________;④低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是______;
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是_________________;
②所称取的样品中NaClO2的物质的量为_______________(用含c、V的代数式表示)。
【答案】 量筒 防止D瓶溶液倒吸到B瓶中(或安全瓶) 2ClO2+2NaOH+ H2O2 = 2NaClO2+O2+2H2O NaClO3和NaCl 用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃) a 滴到最后一滴,溶液蓝色恰好褪去且半分钟内不复原 cV10-3mol
【解析】(1)用50%双氧水配制30%的H2O2溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管、容量瓶,所以玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要量筒。答案为:量筒
(2)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;答案为:防止D瓶溶液倒吸到B瓶中(或安全瓶)
(3)装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O,答案为:2ClO2+2NaOH+ H2O2 =2NaClO2+O2+2H2O
(4) 由题目信息可知,应控制温度38℃~60℃, 高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl。答案为:NaClO3和NaCl
(5)NaClO2饱和溶液在低于38℃时析出NaClO23H2O,从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,所以操作③为用45℃左右的热水洗涤3遍。答案为:用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃)
(6)在B中可能发生反应Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2被带入D中,SO2与H2O2反应生成硫酸钠,a项正确;浓硫酸难挥发,不会进入D,b项错误;硫酸钠是难挥发的盐,也不会进入D,c项错误;选a。答案为:a
(7)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;②令样品中NaClO2的物质的量x,根据化学反应可得关系式,
NaClO2~2I2~4S2O32-
1mol4mol
0.25x c mol·L-1×V×10-3L
列方程解得x= cV10-3mol。答案为: ① 滴到最后一滴,溶液蓝色恰好褪去且半分钟内不复原 ② cV10-3mol


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素在周期表中的位置是_______________________,其基态原子的价层电子排布图为__________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Z的曲线是_________(填标号)。

(3)化合物(XH2=X=O)分子中X原子杂化轨道类型是___________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为______。
(5)某R的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为ρg/cm3,距离最近的两个原子的距离为d pm,则R的相对原子质量为___________________。 (阿伏加德罗常数为NA)

(6)X形成的一种常见单质,性质硬而脆,原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化合物的电子式
(1)K2O_____;
(2)Na2O2_____;
(3)NH4F_____;
(4)Ca(OH)2_____;
(5)CH4_____;
(6)H2O2_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24Cr原子处于基态时,价电子排布可用电子排布图表示成![]() ,而不是
,而不是![]() 。下列说法中,正确的是()
。下列说法中,正确的是()
A. 这两种排布方式都符合能量最低原理
B. 这两种排布方式都符合泡利原理
C. 这两种排布方式都符合洪特规则
D. 这个实例说明洪特规则有时候和能量最低原理是矛盾的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有_________种,铬元素在周期表中_____区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如下图所示),其中C原子杂化方式为__________杂化。
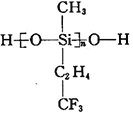
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________(填元素符号)
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO3-的空间构型为__________形,写出一个C1O3-的等电子体的化学符号__________________。
③已知高碘酸有两种形式,化学式分别为H5IO6(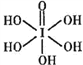 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_________HIO4(填“>”“<”或“= ”)
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+,白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为______________________。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为__________________pm。(写出计算式即可)
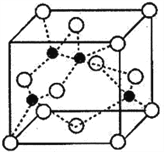
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研究锂硫电池获得突破,电池的总反应是16Li+S8 ![]() 8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
8Li2S ,充放电曲线如图所示,下列说法不正确的是( )
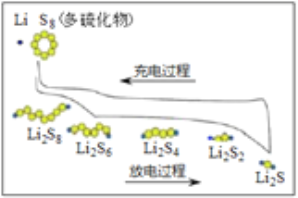
A. 充电时,电能转化为化学能
B. 放电时,锂离子向正极移动
C. 放电时,1mol Li2S6转化为Li2S4得到2mole-
D. 充电时,阳极总电极反应式是8S2- -16e- = S8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A合成聚酯类高分子化合物F的路线如下图所示:

已知:①RCH=CH2 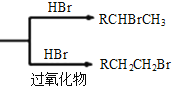 ②丙酮能被KMnO4(H+)氧化,使之褪色
②丙酮能被KMnO4(H+)氧化,使之褪色
(1)A生成B的反应类型为_______,C中含氧官能团的名称为_______。
(2)G是与CH3OH相对分子质量相差56的同系物,且不能使KMnO4(H+)褪色,G的名称为__________________
(3)检验A分子碳碳双键的方法_______________________________________________。
(4)D与NaOH水溶液反应的化学方程式为_____________________________________。
(5)E在一定条件下还可以合成含有六元环结构的H,则H的结构简式为____________。
(6)若F的平均相对分子质量为25200,则其平均聚合度为_______________
(7)满足下列条件的C的同分异构体有____________种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制氢氧化铜悬浊液反应产生2mol砖红色沉淀
(8)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物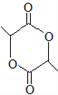 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:![]() 目标产物。__________________
目标产物。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,可用于自来水消毒。1868年,狄肯等科学家发明了在氯化铜催化并加热的条件下,利用空气中的氧气氧化氯化氢制取氯气的方法,译为地康法。其原理可表示为4HCl+O2![]() 2H2O+2Cl2,下列说法正确的是()
2H2O+2Cl2,下列说法正确的是()
A. Cl2是还原产物
B. 生成11.2LCl2(标准状况),转移电子数目为2NA
C. 反应中Cl被氧化,HCl得到电子
D. 氧化性:O2>Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com