
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
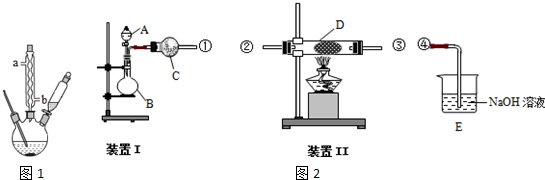
分析 实验一:(1)甲苯易挥发,需要冷凝回流;
(2)苯甲酸微溶于水,常温下为晶体,采取过滤方法分离;
(3)反应得到溶液中含有硫酸锰、硫酸钾,硫酸锰、硫酸钾易溶于水,苯甲酸微溶于水,可以利用重结晶进行提纯;
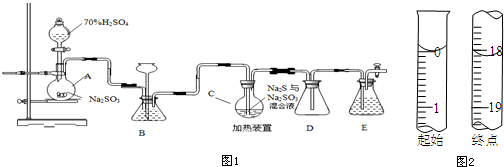
实验二:(1)①根据装置图可知,用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,B中应装过氧化钠,C中盛有碱石灰干燥气体;
②装置1生成的氨气和氧气通关过装置D中的催化剂加热发生反应生成一氧化氮和水,一氧化氮和氧气反应生成红棕色气体二氧化氮,依据元素化合价变化分析氨气具有还原性;
(2)①若用装置Ⅰ制取干燥的SO2气体,需要亚硫酸钠和浓硫酸发生反应;
②碱石灰改为五氧化二磷是为了干燥二氧化硫气体.
解答 解:实验一:(1)①苯易挥发,冷凝管冷凝回流挥发的甲苯,减少损失,
故答案为:冷凝回流;
(2)苯甲酸微溶于水,常温下为晶体,采取过滤方法分离,需要的仪器有:烧杯、玻璃棒、漏斗,
故选:BCD;
(3)反应得到溶液中含有硫酸锰、硫酸钾和剩余的高锰酸钾,分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4、KMnO4,硫酸锰、硫酸钾易溶于水,苯甲酸微溶于水,可以利用重结晶进行提纯,
故答案为:K2SO4、MnSO4、KMnO4;重结晶;
实验二:(1)①依据装置图可知,A为分液漏斗,实验目的是制得氨气和氧气,所以装置B中应装过氧化钠,
故答案为:Na2O2;
②D中氨气和氧气在一定条件下反应生成一氧化氮和水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)①依据装置图分析可知装置B中是制备二氧化硫气体,利用亚硫酸钠固体和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
②仪器C中改为盛装P2O5的作用是除去二氧化硫气体中的水蒸气,起到干燥气体的作用;
故答案为:干燥SO2气体.
点评 本题考查制备方案的设计,题目难度中等,涉及物质的分离提纯、仪器的使用、产率计算等,清楚原理是解答的关键,注意对题目信息的应用,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Fe>Cu | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
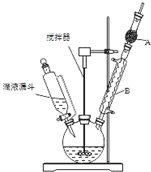 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 1molN4气体完全转变为N2将放出882kJ热量 | |
| B. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| C. | N4属于一种新型的化合物 | |
| D. | 14N与15N化学性质不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com