
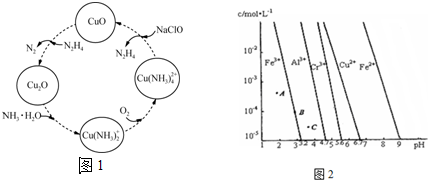
分析 (1)氯化铵溶液中,铵根离子部分水解生成一水合氨和氢离子,溶液显示酸性;加入明矾溶液后,铝离子水解抑制了铵根离子的水解,溶液中铵根离子的浓度增大;
(2)①该反应中H、Na元素都是在化合物,化合价不变;
②温度高时氢氧化铜分解,且气体溶解度随温度升高而降低;
(3)①由图象可知,相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;
②当PH=9时,c(Fe2+)=1×10-5mol•L-1,再根据Ksp表达式求算.
解答 解:(1)氯化铵溶液中,铵根离子发生水解:NH4++H2O?NH3•H2O+H+,溶液呈酸性;
明矾电离出的铝离子发生水解Al3++3H2O?Al(OH)3+3H+,则加入明矾后溶液中氢离子浓度增大,抑制了铵根离子的水解,导致溶液中铵根离子浓度增大,
故答案为:NH4++H2O?NH3•H2O+H+;增大;
(2)①根据图知,H、Na元素都在化合物中,化合价不变,故答案为:氢、钠;
②温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,
故答案为:使Cu(OH)2分解生成CuO;降低N2H4溶解度,促进N2H4的挥发;
(3)①图象分析判断,相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;在过饱和溶液中要有固体析出,C点为过饱和溶液,其溶质的沉淀速率大于溶解速率,
故答案为:Cr(OH)3;C;
②由图象可知,当PH=9时,c(Fe2+)=1×10-5mol•L-1,Ksp=c(Fe2+)•c2(OH-)=1×10-5×(1×10-5)2 =1×10-15,故答案为:1×10-15.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析能力、计算能力的考查,题目涉及氧化还原反应、化学方程式计算等知识点,明确元素化合价是解本题关键,注意该反应中元素化合价发生变化,图象分析判断方法的应用是解题关键,题目难度大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
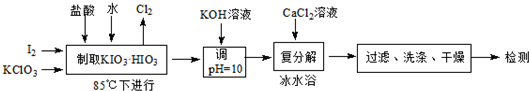
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由此可确定碘元素的相对原子质量为131 | |
| B. | $\stackrel{131}{53}$I是碘元素的一种同位素 | |
| C. | $\stackrel{131}{53}$I核素中含中子数为53 | |
| D. | $\stackrel{131}{53}$I2的摩尔质量为262 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com