
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO${\;}_{3}^{2-}$+2H+═H2O+CO2↑ | |
| D. | NaOH溶液与NaHSO4溶液反应:H++OH-═H2O |
分析 A.2mol钠与水反应生成1mol氢气,该反应违反了电子守恒;
B.钠与硫酸铜溶液反应不会生成铜单质;
C.碳酸氢根离子不能拆开;
D.氢氧化钠与硫酸氢钠反应的实质为氢离子与氢氧根离子反应生成水.
解答 解:A.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.钠与硫酸铜溶液反应生成氢氧化铜沉淀、氢气和硫酸钠,正确的离子方程式为:2Na+2H2O+Cu2+═H2↑+2Na++Cu(OH)2↓,故B错误;
C.NaHCO3溶液与稀H2SO4反应,碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+═H2O+CO2↑,故C错误;
D.氢氧化钠溶液与NaHSO4溶液反应的离子方程式为:H++OH-═H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 保持温度和容器压强不变,充入1 mol NH3(g) | |
| B. | 保持温度和容器体积不变,充入1 mol NH3(g) | |
| C. | 保持温度和容器压强不变,充入1 mol N2(g) | |
| D. | 保持温度和容器体积不变,充入1 mol Ar(g) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
已知:C(s)+H20(g)=CO(g)+H2(g) △H=akJ·mol—1;2C(s)+02(g)=2CO(g) △H=一220kJ·mol—1;H—H、O=0和O—H键的键能分别为436、496和462kJ·mol—1,则a为 ( )
A.—332 B.+130 C.+332 D.—l30
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性:X>W>Z | |
| B. | 元素W最高化合价和最低化合价的代数和为0 | |
| C. | Y与X能形成离子化合物 | |
| D. | 原子半径:Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
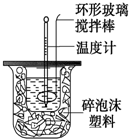 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3 | 验证火柴头含有氯元素 |
| B | 试样加水溶解后,再加入足量Ba(OH)2溶液,有白色沉淀生成 | 检验NaHCO3固体中是否含 Na2CO3 |
| C | 向溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com