
 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | 每转移0.1mol电子,消耗1.12L的H2 | |
| D. | H+由b极通过固体酸电解质传递到a极 |
分析 根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水,以此解答该题.
解答 解:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水,
A.a为负极,b是正极,则电子应该是通过外电路由a极流向b,故A错误;
B.该电池为酸性电池,所以正极电极反应为O2+4e-+4H+=2H2O,故B正确;
C.每转移0.1mol电子,消耗0.05mol的H2,但气体存在的状态未知,体积不一定为1.12 L,故C错误;
D.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D错误.
故选B.
点评 该题是高考中的常见题型,属于中等难度的试题.侧重考查学生灵活运用原电池原理解决实际问题的能力.学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
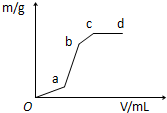 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )| A. | ab段产生的沉淀为硫酸钡 | |
| B. | ab产生段的沉淀为氢氧化镁 | |
| C. | bc段产生的沉淀为氢氧化镁 | |
| D. | bc段产生的沉淀为硫酸钡和氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
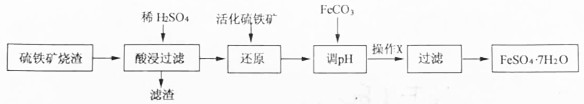
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4FeS2( s)+11O2( g)═2Fe2O3( s)+8SO2(g)△H=-3414.8kJ•moL | |
| B. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=-853.7kJ•moL | |
| C. | 4FeS2(s)+11O2(g)═2 Fe2O3 (s)+8SO2(g)△H+3414.8kJ•moL | |
| D. | FeS2(s)+$\frac{11}{4}$O2(g)═$\frac{1}{2}$Fe2O3 (s)+2SO2(g)△H=+853.7kJ•moL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多 | |
| B. | 植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程 | |
| C. | 在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| D. | 热化学方程式中的△H的值与反应物的用量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7 mol/L | B. | c(OH-)=1×10-7mol/L | ||
| C. | c(H+)=c(OH-) | D. | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂和合成洗涤剂的结构相似,都含有憎水基和亲水基 | |
| B. | 肥皂不适用于硬水中洗涤,合成洗涤剂可以 | |
| C. | 合成洗涤剂难以被微生物分解,所以去污能力比肥皂好 | |
| D. | 肥皂的生产原料是油脂,成本高,合成洗涤剂的生产原料是石油副产品,成本较低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com