
某试液中只可能含有K+、NH4+、Fe2+、Al3+、C lˉ、CO
lˉ、CO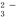 、SO
、SO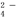 、NO3-中的若干种离子,离子浓度均为0.1 mol·Lˉ1,某同学进行如下实验:下列说法正确的是( )
、NO3-中的若干种离子,离子浓度均为0.1 mol·Lˉ1,某同学进行如下实验:下列说法正确的是( )
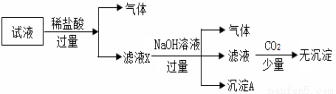
A.原试液中可能含有CO 、K+、NH4+
、K+、NH4+
B.无法确定沉淀A的成分
C.无法确定原试液中 有Al3+、K +、Clˉ
有Al3+、K +、Clˉ
D.原溶液中一定存在的离子为NH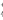 、Fe2+、SO
、Fe2+、SO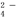 、NO3-
、NO3-
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
工业上制备纯硅反应的热化学方程式为:SiCl4(g)+2H2(g) Si(s)+4HCl(g); △H = + QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
Si(s)+4HCl(g); △H = + QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A. 反应过程中,若将硅移出体系,能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L min)
min)
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:选择题
高温下,某反应达到平衡,平衡常数K=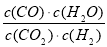 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为 CO+H2O  CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:选择题
下列几种试剂不能把等物质的量浓度的Na2CO3、NaHCO3鉴别开的是( )
A.BaCl2溶液 B.澄清石灰水 C.稀盐酸 D.酚酞溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:填空题
甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2C O2(g) △H=-566.0kJ·mol-1
O2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。

(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
已 知:4HCl(g)+O2 (g)
知:4HCl(g)+O2 (g)  2C12 (g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
2C12 (g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
化学键 | H-Cl | O=O | Cl-Cl | H-O |
E/ kJ·mol-1 | 431 | 497 | a | 465 |
其中a值为( )
A.242 B.303.5 C.180.5 D.365
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.应用铝热反应能焊接钢轨 B.比色法可以测定化学反应速率
C.工业制硝酸需要热交换器  D.反应热均可通过实验直接测定
D.反应热均可通过实验直接测定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
25 ℃、101 kPa 下:①2Na(s)+ O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s)ΔH2=-511 kJ·mol-1下列说法正确的是 ( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ΔH=-317 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:填空题
已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时。
CO2(g)+H2(g),达到平衡时。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为____________;K值为_________。
(2)830K,若只将起始时c(H2O)改为6mol/L,其他条件不变,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com