
科目:高中化学 来源: 题型:






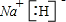
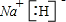
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省芒市中学高二上学期期中考试化学试卷(带解析) 题型:填空题
(14分)已知元素周期表中共有18纵行,如图实线表示元素周期表的边界,按电子排布,可把周期表划分为s区、p区、d区、ds区等。除ds区外,其他区的名称均按构造原理最后填入电子的能级符号来命名。
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区。
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另
一区,你认为应排在________区。
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)。
(4)随着科学技术的发展,不断有新的元素被发现。若把第七周期排满,则元
素周期表共可以排布________种元素。
(5)在周期表中,电负性最大的元素是 ,该元素的原子轨道图 。
写出该单质与水反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013届云南省高一下学期期中考试化学试卷 题型:填空题
A、B、C、D四种元素是元素周期表中前20号元素,其原子序数依次增大,A是元素周期表中原子半径最小的元素,B的最外层电子数是次外层电子数的3倍,A的单质在C的单质中燃烧,发出苍白色火焰,D的原子核外N层电子数是K层电子数的一半。(第1题每空1分,其余每空2分,共16分)
(1)A为 ;B为 ;C为 ;D为 ;(填元素符号)
(2)C离子的离子结构示意图为
(3)A单质的结构式:
(4) C在元素周期表中第 周期, 族。
(5) 写出D与水反应的化学方程式: ,所得溶液的pH 7。
查看答案和解析>>
科目:高中化学 来源:山西省月考题 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:
(本题共10分)元素周期表揭示了许多元素的相似性和递变规律,同一周期元素所构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒。如下列周期表中所示的一些物质或离子。
|
|
| |||||||||||||||
| ① |
|
|
|
| N2H4 | ② | F2 |
| ||||||||
③ | ④ |
| ⑤ | SiH4 | PH3 | ⑥ | ⑦ | Ar | |||||||||
⑧ | Ca2+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)比较③④⑤⑥⑦形成的单核离子的半径大小:_____>_____>_____>_____>_____(写离子符号)
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式___________________________________。
(4)分别写出含有⑥号元素的某种18电子的微粒和含有②号元素的两种10电子的离子间反应的离子方程式:________________________,_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com