
| A. | 丁烷 | B. | 丁烯 | C. | 丁醇 | D. | 丁酸 |
分析 AD可利用烷基的数目多少确定,丙基有2种;
丁烯存在官能团位置异构和碳链异构;
判断和书写醇的异构体可以按照以下步骤来做:
(1)先确定烷烃的碳链异构,即烷烃的同分异构体;
(2)确定烷烃的对称中心,即找出等效的氢原子;
(3)根据先中心后外围的原则,将氯原子逐一去代替氢原子.
解答 解:A.丁烷有2种CH3CH2CH2CH3,CH3CH(CH3)2,故A错误;
B.丁烯有3种CH2=CHCH2CH3,CH3CH=CHCH3,CH2=C(CH3)2,故B错误;
C.丁醇有4种同分异构体,分别是CH3CH2CH2CH2OH,CH3CH2CHOHCH3,(CH3)2CHOHCH3,(CH3)3COH,故C正确;
D.丁酸有2种CH3CH2CH2COOH,(CH3)2CHCOOH,故D错误.
故选C.
点评 本题考查了同分异构体数目的求算,题目难度中等,明确同分异构体的书写原则为解答关键,试题侧重考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | CaCO3+2HCl=CaCl2+CO2↑+H2O | ||
| C. | 2Na2O2+2H2O=4NaOH+O2↑ | D. | Fe+CuSO4=FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极发生的反应为:Fe-2e-═Fe2+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 钢铁发生的是析氢腐蚀 | |
| D. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
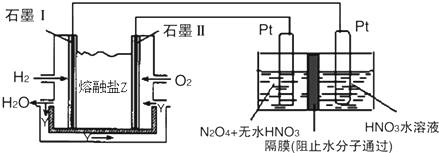
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO═H++ClO- | B. | HCO3?H++CO32- | ||
| C. | Ba(OH)2?Ba2++2OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com