
| ||
| 10min |
| c |
| 2 |
| 3 |
| 2 |
a+
| ||
b+
|
| 2 |
| 4 |


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
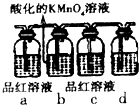 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.查看答案和解析>>
科目:高中化学 来源: 题型:
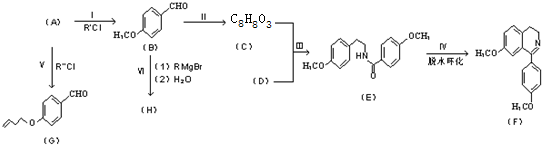
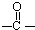 ”结构的物质可发生下列反应:
”结构的物质可发生下列反应: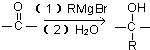
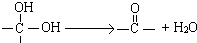
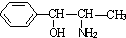 )互为同分异构体
)互为同分异构体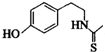 ,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式
,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式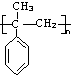 的合成路线流程图:
的合成路线流程图: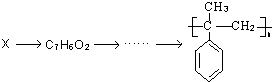
| HBr |
| N2OH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

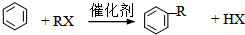
查看答案和解析>>
科目:高中化学 来源: 题型:
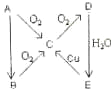 A、B、C、D、E、在一定条件下的转换条件如图所示:
A、B、C、D、E、在一定条件下的转换条件如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室利用Na2SO3与硫酸制取SO2气体时,一般采用浓度较大的硫酸 |
| B、向白纸上滴几滴浓硫酸 |
| C、向浓硫酸中滴加浓盐酸制取HCl气体 |
| D、利用金属Cu与浓硫酸反应制取SO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com