
分析 (1)利用太阳能分解海水是将太阳能转化为化学能;氢氧燃料电池属于原电池,是将化学能转化为电能,断裂化学键需要吸收能量,形成化学键放出能量;
(2)依据元素周期表和元素周期律知识得出Se为VIA族元素,类比S和O回答即可.
解答 解:(1)科学家利用太阳能使海水分解,所以是太阳能转变为化学能,该反应中二氧化钛作催化剂;生成的氢气用于燃料电池时是把化学能转变为电能,水分解时,断裂的化学键是H-O共价键键;电解水是吸热反应,故答案为:太阳;化学;催化剂;化学;电;共价键;吸热;
(2)硒与氧同一主族,Se原子比A原子多两个电子层,则Se的原子序数为34,最外层有6个电子,最高+6价,最低价为-2,最高价氧化物的化学式为SeO3,元素的非金属性越强,其对应氢化物的还原性越弱,非金属性S>Se,故答案为:34;SeO3;强.
点评 本题主要考查了元素周期表和元素周期律、元素化合物知识,中等难度,解题的关键在于根据元素的化合价和原子半径的大小比较确定元素种类.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 对空气进行降温加压 | B. | 金刚石变成石墨 | ||
| C. | NaCl熔化 | D. | 碘溶于CCl4中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
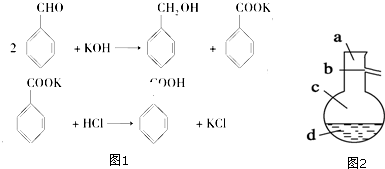
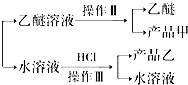
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>C>D>B | B. | A>B>C>D | C. | C>A>D>B | D. | C>B>D>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里生成 n mol A2,同时消耗 2n mol AB | |
| B. | 容器中的总压强不随时间而变化 | |
| C. | A2、B2、AB的物质的量之比满足1:1:2 | |
| D. | 单位时间里生成2n mol AB的同时生成n mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
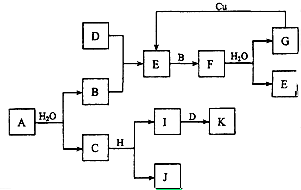 A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
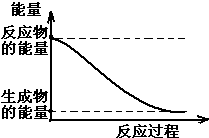 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热.(填“吸热”或“放热”)反应,NO2和CO的总能量大于(填查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com