
【题目】氯气是一种重要的工业原料。
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是:__________。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质:

①在该实验中,甲部分的装置是__________(填字母)。
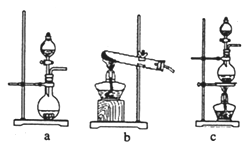
如何检查该装置的气密性?__________________________________________。
②乙装置中FeCl2溶液与Cl2:反应的离子方程式是_______________。
③丙装置中通人少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是____________。
④该实验存在明显的缺陷,改进的方法________________________________。
【答案】2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2Oc关闭分液漏斗活塞,将导气管末端伸入盛水的烧杯中,用手捂热烧瓶,导气管口有气泡冒出,冷却后,导气管末端形成一段稳定的水柱2Fe2++Cl2 = 2Fe3++2Cl-Cl2+2Na2CO3 +H2O=NaCl+NaClO+2NaHCO3在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶
【解析】
(1)实验室可用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式是2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O;(2)①A部分是氯气发生装置,而此装置为固液加热型装置,a装置适用于固液不加热型,b适用于固体加热型,c适用于固液加热型,故选c;检查该装置的气密性的方法是关闭分液漏斗活塞,将导气管末端伸入盛水的烧杯中,用手捂热烧瓶,导气管口有气泡冒出,冷却后,导气管末端形成一段稳定的水柱,说明气密性良好。②乙装置中FeCl2溶液与Cl2反应离子方程式是2Fe2++Cl2 =2Fe3++2Cl-;③Cl2+2Na2CO3 +H2O=== NaCl+NaClO+2NaHCO3,④整个反应过程中由于氯气具有毒性,因此装置的末尾应加上一个尾气处理装置,可用碱性溶液吸收。


科目:高中化学 来源: 题型:
【题目】取一定量的Na2CO3和NaHCO3固体混合物加热至无气体放出为止,称得加热后剩余固体质量比原来减少了6.2 g,现再取同样质量的原固体混合物与过量的盐酸反应,生成15.68 L CO2(标准状况)。请计算:
(1)加热后剩余固体物质的成分是什么_________?
(2)混合物中Na2CO3和NaHCO3的物质的量分别是多少______________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为a g,将它们在氧气中完全氧化的产物全部通入到足量的过氧化钠固体中,过氧化钠固体增重为a g,符合条件的物质种类有( )
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH
A. 4 种 B. 5 种 C. 6种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是 反应(填“吸热”、“放热”).
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”、“减小”、“不变”),原因是
(3)反应体系中加入催化剂对反应热是否有影响? (填“有”、“无”),原因是 .
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 在溶液中有:2
在溶液中有:2![]() (黄)+2H+
(黄)+2H+![]()
![]() (橙)+H2O的转化。室温下初始浓度为1.0 mol/L的Na2CrO4溶液中c(
(橙)+H2O的转化。室温下初始浓度为1.0 mol/L的Na2CrO4溶液中c(![]() )随c(H+)的变化如图所示。不正确的是( )
)随c(H+)的变化如图所示。不正确的是( )

A. 向Na2Cr2O7溶液中加NaOH固体,溶液的颜色为黄色
B. 由图可知,溶液酸性增大,![]() 的平衡转化率增大
的平衡转化率增大
C. 根据A点数据计算出该转化反应的平衡常数为1 (mol·L-1)-3
D. 温度升高,溶液中![]() 的平衡转化率减小,则该反应为放热反应
的平衡转化率减小,则该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。某工厂设计下列流程图,完成回收硫酸亚铁和铜的简单实验方案。
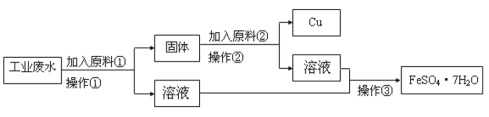
(1)操作①的名称为______,该操作所需要的玻璃仪器为______、_____、烧杯。
(2)原料②的化学式为__________,发生的离子方程式为_________________。
(3)为验证上述流程图中的溶液中含有SO42-:取少量的溶液于试管中,先加入______,再加入________,若观察到有__________,则说明溶液中含有SO42-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常采用以下装置来制备纯净干燥的氯气,回答下列问题:
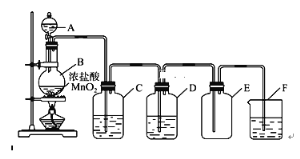
(1)写出实验室制备氯气的化学反应方程式:____________________________________。
(2)在反应中MnO2发生______(填“氧化”或“还原”,下同)反应,Cl2是______产物。
(3)装置C中所装试剂为________,其作用为_______________________________。
(4)检验氯气是否收集满的方法为:_________________________________________。
(5)F中反应的离子反应方程式为_________________________________________。
(6)工业上常用氯气与石灰水反应制备漂白粉,而久置漂白粉容易失效,请写出漂白粉失效的原理____________________________,_______________________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知草酸(H2C2O4)可使H2SO4酸化的KMnO4溶液褪色,请回答以下问题:
①在该反应中0.2mol高锰酸钾可得到1mol电子,该反应的还原产物为________(写化学式)
②请补全并配平该反应方程式:
___H2C2O4+ KMnO4+ H2SO4 → K2SO4+ + CO2↑ + H2O
(2)某溶液中可能含有以下离子:Na+、K+、Fe3+、CO32-、SO42-、Cl-,现进行如下实验:

根据实验现象回答:
该溶液中一定含有的离子是______________;一定不含有的离子是____________;无法确定的离子是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com