
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ④⑤ | D. | ①②③⑤ |
科目:高中化学 来源: 题型:选择题
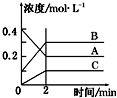
| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  给液体加热 | B. | 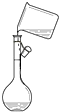 转移溶液 | C. | 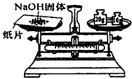 称取NaOH固体 | D. | 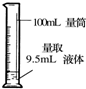 量取液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaOH溶液 | B. | 2 mol•L-1HCl溶液 | ||
| C. | 3 mol•L-1 NaCl溶液 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下二者都可用铁制容器贮存 | B. | 常温下二者都能与铜较快反应 | ||
| C. | 露置于空气中,溶液浓度均降低 | D. | 浓HNO3与浓H2SO4都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:16 | B. | 16:1 | C. | 17:7 | D. | 5:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com