
| A. | 在相同的条件下,红磷比白磷稳定 | |
| B. | 在相同的条件下,白磷比红磷稳定 | |
| C. | 红磷和白磷的化学性质相同 | |
| D. | 红磷容易发生自燃而白磷则不会自燃 |
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
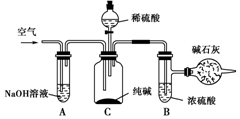 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量.
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如图所示的装置测定工业纯碱中有效成分的含量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
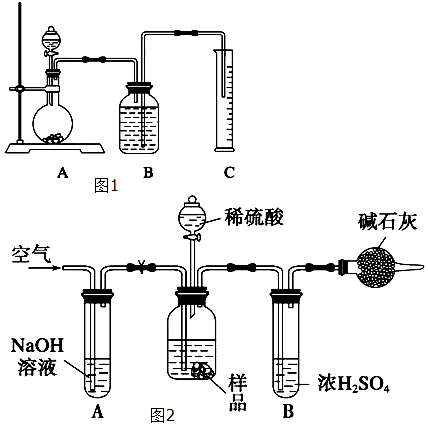
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
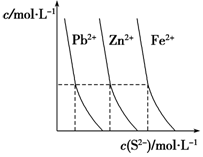 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:
高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物 | B. | 同位素 | C. | 同分异构体 | D. | 同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com