
| | 实验事实 | 热化学方程式 | 评价 |
| A | 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq)= BaSO4(s)+ 2H2O(l) △H=-114.6 kJ·mol-1 | 正确 |
| B | 醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1 | 不正确;因为醋酸状态为“aq”,而不是“l”。 |
| C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1 | 不正确;因为反应热为△H=-260.6 kJ·mol-1 |
| D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1 | 不正确;同素异形体要注名称:C(石墨) |


科目:高中化学 来源:不详 题型:单选题

| A.△E1是该反应的活化能 |
| B.△E2是2mol HCl(g)的总键能 |
| C.该反应的热化学方程式为:H2(g)+Cl2(g)=2 HCl(g) △H=-183KJ/mol |
| D.该反应是一个吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 |
| B.1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 |
| C.(CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 |
| D.断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定中和热的实验中每次实验需要测定三次温度数据 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.凡经加热而发生的化学反应都是吸热反应 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
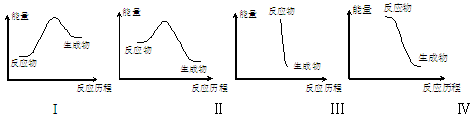
| A.I可表示需加热的放热反应 | B.Ⅱ可表示需加热的放热反应 |
| C.Ⅲ可表示爆炸反应 | D.Ⅳ可表示酸和碱的中和反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ΔH1 >ΔH2 | B.ΔH2>ΔH3>ΔH1 | C.ΔH1=ΔH2=ΔH3 | D.ΔH1>ΔH3>ΔH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=" -216" KJ/mol,反应物总能量小于生成物总能量 |
| B.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E2=E1 |
| C.101KPa时,2H2(g)+O2(g) =2H2O(l) △H=" -517.6" KJ/mol,若生成气态水,△H小于-517.6 KJ/mol |
| D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中的能量变化都表现为热量变化 | |
B.凡是需要加热后才能发生的反应是吸热反应 | C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 |
| D.物质发生化学反应都伴随着能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com