
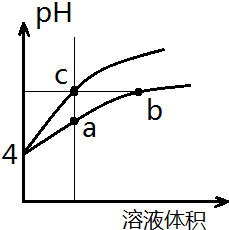
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)=c(OH-)+c(NH3•H2O) | |
| C. | a、b、c三点溶液水的电离程度a>b>c | |
| D. | 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
分析 根据盐酸是强酸,完全电离,氯化铵是能水解的盐,水解显示酸性,加水稀释促进水解的进行,
A、溶液的导电能力和溶液中自由移动离子的浓度有关;
B、根据溶液中的质子守恒来回答;
C、盐酸对水的电离起抑制作用,氯化铵对水的电离起到促进作用;
D、b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而C点只有盐酸消耗NaOH(盐酸完全电离);
解答 解:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的.
A、溶液的导电能力和溶液中自由移动离子的多少有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,故A错误;
B、b点溶液中,根据质子守恒,得出c(OH-)+c(NH3•H2O)=c(H+),故B正确;
C、盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,故C正确.
D、用等浓度NaOH溶液和等体积b、c处溶液反应,b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而C点只有盐酸消耗NaOH(盐酸完全电离),故消耗NaOH溶液体积Vb>Vc,故D错误;
故选B.
点评 本题考查酸溶液的稀释,注意弱电解质溶液稀释时的浓度变化及加水促进弱电解质电离的特点即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
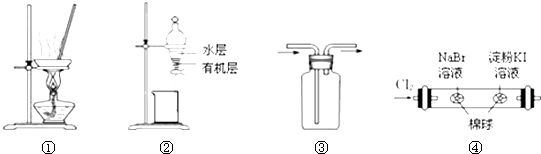
| A. | 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 用图②所示装置,分离CCl4萃取碘水后的有机层和水层 | |
| C. | 按装置③所示的气流方向可用于收集H2、NH3等 | |
| D. | 用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32--+2H+═H2O+CO2↑ | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com