
分析 石灰增重0.600g生成CO2与H2O的总质量,根据质量守恒,为CH4与反应的O2的总质量,设CH4的物质的量为xmol,根据方程式表示出消耗氧气物质的量,再根据CH4与反应的O2的总质量列方程计算解答.
解答 解:由题知0.600g为生成CO2与H2O的总质量,根据质量守恒,也是CH4与反应的O2的总质量.
设CH4的物质的量为xmol,由CH4+2O2=CO2+2H2O,可知反应氧气的物质的量为2xmol,则:
44x+36x=0.600
解得:x=0.0075
V(CH4)=0.0075mol×22.4L/mol=0.168L=168mL
反应消耗的氧气的体积为:168mL×2=336mL
碱石灰吸收后所剩余的体积为:840mL-168mL-336mL=336mL
答:碱石灰吸收后所剩气体的体积336mL.
点评 本题考查混合物计算,关键是利用质量守恒定律确定参加反应氧气与甲烷总质量,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W |
| A. | 五种元素中,原子半径最大的是W | |
| B. | Y 的氧化性比W的氧化性强 | |
| C. | Y与Z形成的化合物都可以和水反应 | |
| D. | Z与Q形成的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3 | B. | C${H}_{3}^{-}$ | C. | SO3 | D. | H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 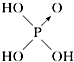 | 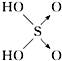 | 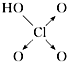 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O; ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染 | |
| B. | 二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸 | |
| C. | 两种气体都具有强氧化性,因此都能够使品红溶液褪色 | |
| D. | 两种气体溶于水都可以与水反应,且只生成相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
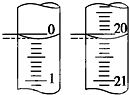 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
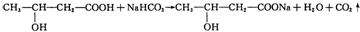 .
. .
.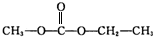 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com