
【题目】根据下图回答,下列说法不正确的是( )
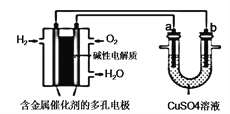
A. 此装置用于电镀铜时,电解一段时间,理论上硫酸铜溶液的浓度不变
B. 若a为粗铜,b为纯铜,该装置可用于粗铜的电解精炼
C. 燃料电池中负极反应为2H2-4e-+4OH- = 4H2O
D. 上述装置在工作过程中Cu2+ 向a电极移动
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1) 在一定条件下将CO2 和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g) +H2(g)![]() CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+H2O(g) △H1=+41KJ/mol
CO(g) +2H2(g)![]() CH3OH(g) △H2=-90KJ/mol
CH3OH(g) △H2=-90KJ/mol
则由CO2和H2转化为甲醇蒸气和水蒸气的热化学方程式为_____________________________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
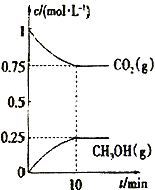
①能说明该反应已达平衡状态的是________________________。
A.单位时间内有3n molH-H键断裂,同时又有2n mol O-H键断裂
B.混合气体的密度不随时间变化
C.体系中n(CO2)/n(H2)=1∶1,且保持不变
D. CO2的体积分数在混合气体中保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是_______________。
A.升高温度 B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂 D.恒温恒容充入He使体系压强增大
③计算该温度下此反应的平衡常数K=_________(保留3位有效数字);若使K的值变为1,则应采取的措施是___________________________。
A.增大压强 B.恒压加入一定量H2 C. 升高温度 D. 降低温度
(3)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1mol/LNa2CO3溶液完全捕捉0.44gCO2气体(溶液体积变化不变),所得溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=________ mol/L
(4)被誉为改变未来世界的十大科技之一的燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,正以势不可挡之势挤入汽车工业和电力工业。写出甲醇燃料电池碱性电解质(铂为两极。电解液为KOH 溶液)的负极电极反应:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2 , 发生如下反应: ①2NO(g)+O2(g)2NO2(g)
②2NO2(g)N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )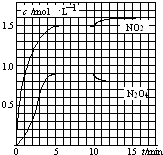
A.前5min反应的平均速率v(N2O4)=0.36mol(Lmin)﹣1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4 , T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
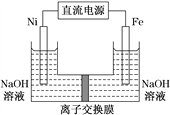
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B. 电解一段时间后,镍电极附近溶液的c(OH-)减小
C. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
D. 每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
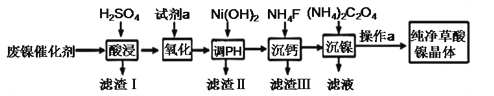
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷和氯气光照条件下发生取代反应后,得到的有机产物有5种
B. 乙烷中混有的少量乙烯,可通入氢气让乙烯和氢气发生加成反应来除去乙烯
C. 乙烯和乙炔都能使溴水褪色,但可通过燃烧现象的不同来区别它们
D. 氨基酸、蛋白质在一定条件下都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是
A. 食盐和蔗糖熔化 B. 钠和硫熔化
C. 碘和干冰升华 D. 二氧化硅和氧化钠熔化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com