
| A. | 8种 | B. | 14种 | C. | 16种 | D. | 18种 |
分析 有机物甲的分子式为CxHyO2,其中氧的质量分数为20.25%,可有:$\frac{32}{12X+Y+32}$×100%=20.25% ①
碳的质量分数为68.35%,可有:$\frac{12X}{12X+Y+32}$×100%=68.35% ②
联立①②,解得X和Y的值;
根据有机物甲的分子式应为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,则有机物甲为酯.由于同质量的乙和丙的蒸气所占体积相同,说明乙和丙的相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,判断5碳醇属于醇的同分异构体,4碳羧酸属于羧酸的异构体数目.据此判断有机物甲的同分异构体数目.
解答 解:有机物甲的分子式为CxHyO2,其中氧的质量分数为20.25%,可有:$\frac{32}{12X+Y+32}$×100%=20.25% ①
碳的质量分数为68.35%,可有:$\frac{12X}{12X+Y+32}$×100%=68.35% ②
联立①②,解得X=9,Y=18,即此有机物为C9H18O2.
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,则有机物甲为酯.由于同质量的乙和丙的蒸气所占体积相同,说明乙和丙的相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子.
含有4个C原子的羧酸有2种同分异构体:CH3CH2CH2COOH,CH3CH(CH3)COOH.
含有5个C原子的醇的有8种同分异构体:CH3CH2CH2CH2CH2OH,CH3CH2CH2CH(OH)CH3,CH3CH2CH(OH)CH2CH3;
CH3CH2CH(CH3)CH2OH,CH3CH2C(OH)(CH3)CH3,CH3CH(OH)CH(CH3)CH3,CH2(OH)CH2CH(CH3)CH3;
CH3C(CH3)2CH2OH.
所以有机物甲的同分异构体数目有2×8=16.
故选:C.
点评 考查同分异构体数目的判断,难度中等,清楚饱和一元醇与少一个C原子的饱和一元羧酸的相对分子质量相同是解题关键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- | |
| C. | 氢氧燃料电池中,氢气在负极发生氧化反应 | |
| D. | 将地下钢管与直流电源的正极相连,用来保护钢管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl常用于保存食物 | |
| B. | 烹鱼时加入少量酒、食醋,美味又营养 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 燃煤中加入CaCO3,可减少SO2气体对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合液中NO3-的物质的量为0.4 mol | |
| B. | OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 | |
| C. | 溶液中最终溶质为FeSO4 | |
| D. | c(H2SO4)为5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 816O2是818O2的同分异构体 | B. | 818O2是O3的一种同素异形体 | ||
| C. | 816O2与818O2互为同位素 | D. | 1mol 818O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
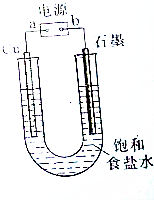 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com