
 亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:
亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:分析 (1)由仪器结构特征,可知仪器A为恒压滴液漏斗;分离两种互不相溶的液体在分液漏斗中进行;氢氧化钠溶液可以吸收酸性气体;
(2)制得的亚磷酸二乙酯中有PCl3、HCl等酸性物质,可以用碳酸钠除去,而去离子水可以除去Na2CO3及部分C2H5OH,据此答题;
(3)反应后的混合溶液中有CHCl3、C2H5Cl、C2H5OH等,都可以用减压蒸馏得到;
(4)化学方程式为PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)由仪器结构特征,可知仪器A为恒压滴液漏斗;分离两种互不相溶的液体在分液漏斗中进行,所以仪器B名称为分液漏斗;三氯化磷和无水乙醇制备亚磷酸二乙酯,根据元素守恒可知,产物质中有氯化氢,氢氧化钠溶液可以吸收氯化氢气体,
故答案为:恒压滴液漏斗;分液漏斗;吸收反应生成的HCl;
(2)制得的亚磷酸二乙酯中有PCl3、HCl等酸性物质,可以用碳酸钠除去,而去离子水可以除去Na2CO3及部分C2H5OH,
故答案为:除去PCl3、HCl等酸性物质;除去Na2CO3及部分C2H5OH;
(3)反应后的混合溶液中有CHCl3、CH3CH2Cl、CH3CH2OH等,都可以用减压蒸馏得到,
故答案为:CHCl3、CH3CH2Cl、CH3CH2OH;
(4)化学方程式为PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O,可知0.2molPCl3恰好和0.8mol无水乙醇反应生成亚磷酸二乙酯为0.2mol,其质量为27.6g,所以其产率为(23.32g÷27.6g)×100%=84.5%,
故答案为:84.5%.
点评 本题考查了有机物的制备实验,为高考常见题型,涉及化学仪器识别、对试剂与操作的分析平衡、化学平衡移动、物质的分离提纯、产率计算等,侧重考查学生分析解决问题能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 硫酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 碱石灰 | 硫酸钡 | NH3 |
| C | 纯碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
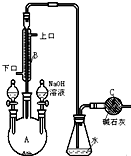 制备溴苯的实验装置如右图所示,请回答下列问题:
制备溴苯的实验装置如右图所示,请回答下列问题: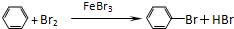 .
. +Br+→[
+Br+→[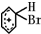 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反应可推知:
+HBr+FeBr3.由上述反应可推知: +Br2→
+Br2→ +HBr 中的催化剂为BD.(填字母)
+HBr 中的催化剂为BD.(填字母)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
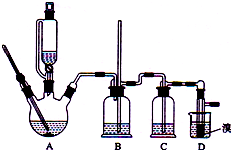 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯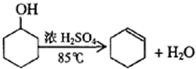
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
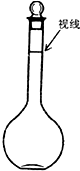 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com