
��11�֣���Ӧ��Fe��s��+CO2��g��FeO��s��+CO��g����H=akJ��mol��1��ƽ�ⳣ��ΪK����Ӧ��CO��g��+1/2O2��g��=CO2��g�� ��H=bkJ��mol��1
����ڲ�ͬ�¶��£�Kֵ���£�
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
��1����500��ʱ���з�Ӧ�٣�CO2��ʼŨ��Ϊ2mol��L��1��CO��ƽ��Ũ��Ϊ_____________��
��2����Ӧ���е�a__________0������ڡ�С�ڡ����ڣ���
��3��700�淴Ӧ�ٴﵽƽ�⣬Ҫʹ�ø�ƽ�������ƶ���������������ʱ�����Բ�ȡ�Ĵ�ʩ��__________������ţ�
A.��С��Ӧ����� B.ͨ��CO2
C.�����¶ȵ�900�� D.ʹ�ú��ʵĴ���
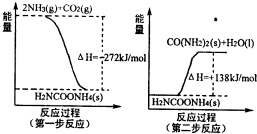
��4������ͼ����Ϸ�Ӧ�ٵ���___________������ţ���ͼ��![]() �����ʡ�
�����ʡ�![]() Ϊ�������CO������TΪ�¶���T1��T2��
Ϊ�������CO������TΪ�¶���T1��T2��
��5���ɷ�Ӧ�ٺ͢ڿ���ã���Ӧ2Fe��s��+O2��g��=2FeO��s���ġ�H=__________��
 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
2- 3 |
- 3 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A������ѡѧ����ѧ�������������
A������ѡѧ����ѧ�������������| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������¶ȸ÷�Ӧ������Ӧ���������淴Ӧ���ʼ�С | ||
B���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=
| ||
| C�����������н��и÷�Ӧ���¶Ȳ��ٱ仯����ﵽ��ѧƽ��״̬ | ||
| D���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com