
| A. | SiO2的摩尔质量是60 | |
| B. | 1mol SiO2中含有1mol O2 | |
| C. | 1.5mol SiO2中含有1.806×1024个氧原子 | |
| D. | 1mol SiO2的质量是60g•mol-1 |
分析 A、摩尔质量的单位是g/mol;
B、二氧化硅是由硅原子和氧原子构成的;
C、1mol二氧化硅是由1mol硅原子和2mol氧原子构成的;
D、质量的单位是克.
解答 解:A、SiO2的摩尔质量是60g/mol,摩尔质量的单位是g/mol,故A错误;
B、二氧化硅是由硅原子和氧原子构成的,其中没有氧气分子,故B错误;
C、1mol二氧化硅是由1mol硅原子和2mol氧原子构成的,所以1.5molSiO2中含有3mol即1.806×1024个氧原子,故C正确;
D、1mol SiO2的质量是60g,故D错误.
故选C.
点评 本题考查学生二氧化硅的构成和性质,可以根据所学知识进行回答,难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 85% | C. | 90% | D. | 95% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
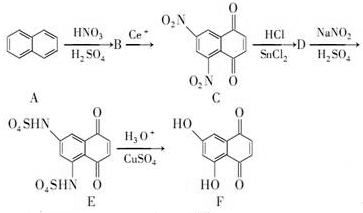
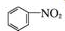 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$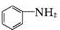 +SnCl4
+SnCl4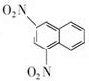 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
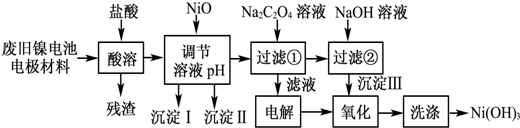
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | NaHCO3溶液:c(OH-)=c(H+)+c(H2CO3-)-c(CO32-) | |
| C. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
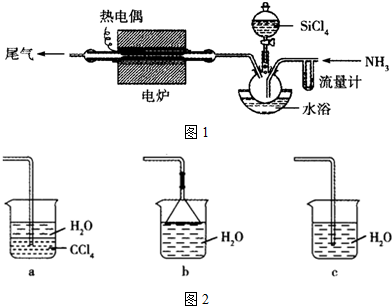
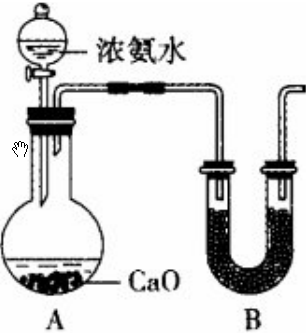
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com