
【题目】I、下图为汽车尾气处理系统中“三元催化”的工作原理,NO和CO在催化剂作用下生成无污染性物质的方程式2NO+2CO![]() N2+2CO2。
N2+2CO2。
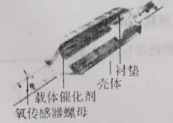
某课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
实验编号 | 实验目的 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 同种催化剂的比表面积/m2·g-1 | c(CO)不变时所用的时间/min |
① | 参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
② | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
③ | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
(1)实验编号②的实验目的为_______。
(2)课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是________。
II、某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
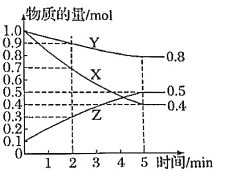
(1)该反应的化学方程式是______。
(2)该反应达到平衡状态的标志是
A. Y的体积分数在混合气体中保持不变
B. X、Y的反应速率比为3:1
C. 容器内气体压强保持不变
D. 容器内气体的总质量保持不变
E. 生成1 mol Y的同时消耗2 mol Z
(3)2~5min内用X表示的化学反应速率为_____。
【答案】探究同种催化剂的比表面积对反应速率的影响 温度 3X(g)+Y(g)2Z(g) AC 0.025mol·L-1·min-1
【解析】
I、根据控制变量的实验探究思想进行分析解答;
II、(1)根据参加反应的各物质的物质的量的变化量之比等于其化学计量数之比判断该反应的化学方程式;
(2)根据化学平衡状态的判断标准进行分析;
(3)根据化学反应速率的计算公式进行计算。
I、(1)实验①和实验②的反应条件中,除了同种催化剂的比表面积大小不同以外,其它条件完全相同,说明实验编号②的实验目的是探究同种催化剂的比表面积对反应速率的影响;
(2)实验①和实验③的反应条件中,除了温度不同以外,其它条件完全相同,可见是探究温度对速率的影响;
II、(1)根据图知,随着反应的进行,X、Y的物质的量逐渐减少,Z的物质的量逐渐增加,则X和Y是反应物,Z是生成物,反应达到平衡时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.0-0.8)mol=0.2mol、△n(Z)=(0.5-0.1)mol=0.4mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量的变化量之比等于其化学计量数之比,X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,则该反应的化学方程式为3X(g)+Y(g)2Z(g);
(2)A. Y的体积分数在混合气体中保持不变,说明各物质的量不变,反应达到平衡状态,故A正确;
B. X、Y的反应速率比为3:1时,如果反应速率都是指同一方向的反应速率,则该反应不一定达到平衡状态,故B错误;
C. 该反应前后气体物质的量发生变化,随着反应进行,容器内压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故C正确;
D. 各物质均为气态,反应前后容器内气体的总质量一直保持不变,不能判定反应是否达到平衡状态,故D错误;
E. 无论反应是否达到平衡状态都存在生成1molY同时消耗2molZ,速率同向,不能据此判断平衡状态,故E错误;
故选AC;
(3)2~5min内,△n(X)=(0.7-0.4)mol=0.3mol,则用X表示的化学反应速率为![]() 。
。


科目:高中化学 来源: 题型:
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为![]() 的①
的①![]() 溶液 ②
溶液 ②![]() 溶液③
溶液③ ![]() 溶液各25mL,下列说法正确的是
溶液各25mL,下列说法正确的是
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是①
C.若分别加入25mL ![]() 盐酸后,pH最小的是②
盐酸后,pH最小的是②
D.若升高温度,则③的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锂电池放电的装置图,电池反应为4Li+FeS2=Fe+2Li2S,LiPF6是电解质,SO(CH3)2是溶剂。下列说法正确的是( )

A.a极是正极B.电子从b极流出经外电路流入a极
C.Li+向b极迁移D.可用水代替SO(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两个完全相同的装置,某学生分别在它们的侧管中装入![]()
![]() 和
和![]()
![]() ,A、B中分别有10mL相同浓度的盐酸(不考虑盐酸的挥发),将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
,A、B中分别有10mL相同浓度的盐酸(不考虑盐酸的挥发),将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )

A.B装置的气球膨胀的体积大
B.最终两试管中NaCl的物质的量一定相同
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于![]()
D.若最终两气球体积相同,则盐酸的浓度一定大于或等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是
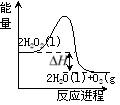
A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是
A. 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热
B. 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热
C. 若该反应为放热反应,则Q1+Q2<Q3
D. 若该反应为吸热反应,则Q1+Q2<Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.
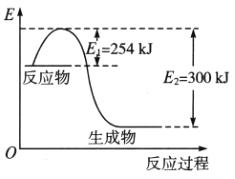
(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com