
分析 (1)浓硫酸具有强氧化性、酸性,P2O5是非氧化性干燥剂,然后结合各选项中气体的性质进行判断;
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol ①;
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol ②;
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol③.
结合目标反应,利用盖斯定律将所给的反应做相应的变形,反应热做相应的变化即可,据此分析;
(3)在原电池的正极上发生得电子的还原反应,即正极上高铁酸根离子得电子和水反应生成氧化铁和氢氧根离子.
解答 解:(1)浓硫酸具有强氧化性、酸性,不能干燥具有还原性、碱性的气体,
a.NH3为碱性气体,不能用浓硫酸和五氧化二磷干燥,可用碱石灰干燥,故错误;
b.HI为还原性气体,不能利用浓硫酸干燥,可以利用P2O5干燥,故正确;
c.二氧化硫为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故错误;
D、CO2为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故D错误;
故答案为:b;
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H1=-90.8kJ/mol ①;
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol ②;
2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol③,
将③+②×2-①×2可得:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H4=△H3+2△H2-2△H1=-1527.6KJ/mol,
故答案为:-1527.6KJ/mol;
(3)正极上高铁酸根离子得电子和水反应生成氧化铁和氢氧根离子,电极反应式为2FeO42-+6e-+5H2O=Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O=Fe2O3+10OH-.
点评 本题考查了干燥剂的选择、反应热的计算、盖斯定律的应用、电极反应的书写,题目难度不大,注意把握盖斯定律的含义和热化学方程式的书写要求.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:解答题
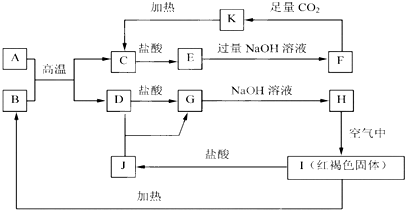
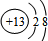 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
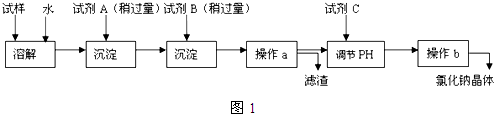
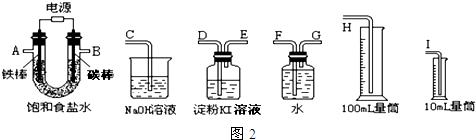
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
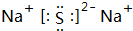 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
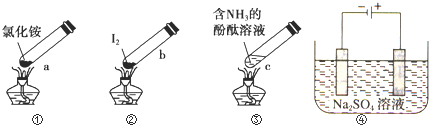
| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
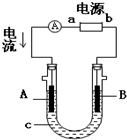 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu、Ag、Al、Mg | B. | Mg、Cu、Al、Ag、Fe | C. | Al、Cu、Ag、Mg、Fe | D. | Mg、Ag、Cu、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图1装置测定中和热的实验步骤如下:
利用如图1装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | 温度差平均值(t2-t1)℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com