
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构.其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A﹣X形成的共用电子对之间的斥力越强;
iv、其他.
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表__:

(2)H2O分子的立体构型为:__,请你预测水分子中∠H﹣O﹣H的大小范围__;
(3)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S﹣Cl、S﹣F之间以单键结合.请你预测SO2Cl2和SO2F2分子的立体构型:__,SO2Cl2分子中∠Cl﹣S﹣Cl__(选填“<”、“>”或“=”)SO2F2分子中∠F﹣S﹣F。
(4)用价层电子对互斥理论(VSEPR)判断SO32﹣离子的空间构型:__。
【答案】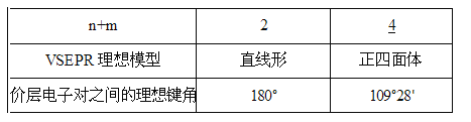 V形 ∠H﹣O﹣H<109°28′ 四面体 > 三角锥形
V形 ∠H﹣O﹣H<109°28′ 四面体 > 三角锥形
【解析】
(1)当n+m=4时,VSEPR模型为四面体形,当n+m=2时,VSEPR模型为直线形;
(2)根据H2O属AX2E2, n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对来判断分子的立体构型;水分子属AX2E2, n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i来判断键角;
(3)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对来判断分子的立体构型;X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
(4)根据价层电子对互斥理论确定亚硫酸根离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=1/2(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。
(1)当n+m=4时,VSEPR模型为四面体形,其键角是109°28′,当n+m=2时,VSEPR模型为直线形,其键角是180°;
因此,本题正确答案是:

(2)H2O属AX2E2, n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对,所以分子的构型为V形;水分子属AX2E2, n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i,应有∠H﹣O﹣H<109°28′;
因此,本题正确答案是:V形;∠H﹣O﹣H<109°28′。
(3)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对,所以分子构型为四面体,F原子的得电子能力大于氯原子,因为X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中∠Cl﹣S﹣Cl> SO2F2 分子中∠F﹣S﹣F ;
因此,本题正确答案是:四面体;>。
(4)该离子中价层电子对个数=3+1/2(6+2-3×2)=4,且含有一个孤电子对,所以VSEPR理想模型是四面体形,立体构型是三角锥形;
因此,本题正确答案是:三角锥形。


科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是

A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX、HY均为一元强酸
B. 溶液中水的电离程度:a = b < c
C. 常温下,HY的电离常数Ka约为1.0×10-4
D. c点溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
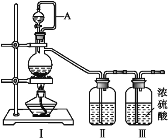
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。

(1)装置甲中仪器A的名称是_____________,丙中应装的溶液是________________,甲装置中发生反应的离子方程式为__________________________________________________。制取收集纯净氯气的装置接口连接顺序是a→ _____________→g(补充完整)。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是____________;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?_____。填“是”或“否”)用0.10 molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图所示,其读数为_____ mL。

b.平行滴定后获得实验结果。
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11
(3)某同学认为上述方案存在明显的缺陷,请指出_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X原子在第二电子层上只有一个空轨道,则X是__;其轨道表示式为__;R原子的3p轨道上只有一个未成对电子,则R原子可能是__、 ;Y原子的核电荷数为29,其电子排布式是__,其在元素周期表中的位置是__,是属于__区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:__、__、__。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子__。![]()
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)__。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4__H2SO3;H3PO4__H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为__杂化,分子的立体构型为__。
BF3分子中,中心原子的杂化方式为__杂化,分子的立体构型为__。
(7)H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有原子序数之和为51的5种短周期元素A,B,C,D,E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价与负价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
(1)试写出它们的元素符号。__________________________________________。
(2)写出B的氢化物的电子式_____________________________。
(3)由A、D两种元素形成的化合物是________化合物(填“离子”或“共价”),化合物内存在________键(填“离子”或“共价”)。
(4)由D、E两种元素形成的化合物的电子式为________,它属于________化合物,化合物内存在________键。
(5)下列关于A,B,C,D,E 5种元素形成的物质的有关叙述正确的是________(多选)。
a.A,B,C,D都能通过共价键形成单质,其中B形成的单质性质最稳定,是因为其原子半径最小
b.A,B,D 3种元素为非金属元素,它们共同组成的化合物一定是共价化合物
c.B,E形成的化合物E3B2应为离子化合物
d.5种元素两两组合形成的化合物中既有共价化合物,又有离子化合物
e.5种元素形成简单离子的离子半径大小为C>D>B>E>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为 Ca(OH)2 和 CaCO3]为原料制备 KClO3 的流程如下:

下列说法正确的是
A. 打浆步骤,将电石渣配制成溶液
B. 氯化步骤,发生的主要反应 2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
C. 转化步骤,发生复分解反应,将所得溶液蒸发结晶过滤得 KClO3 晶体
D. KClO3 晶体中可能混有 KCl、KClO 等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸:AgNO2+HNO3= AgNO3+ HNO2。
(1)利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2
① 写出利用装置Ⅰ制备氯气的离子反应方程式:_________。
② 利用上述装置制备NO时,Ⅱ中盛装物质为_________(写化学式)。
(2)利用以下装置在常温常压下制备ClNO
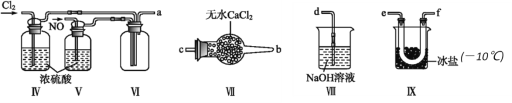
① 装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
② 为使NO和Cl2恰好完全反应生成ClNO,理论上通入NO和Cl2两种气体的流速比为_________。
③ 装置Ⅸ的作用是_____________。
④ 装置Ⅷ吸收尾气时,有同学认为尾气中的某种气体不能完全被吸收,为了充分吸收尾气,可将尾气与______________(气体)同时通入NaOH溶液中。
⑤ 王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2,该反应的化学方程式为______________________________________。
⑥ 写出验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2的实验步骤:取少量反应后的溶液于试管中,______________________________________________________。(限选试剂如下:AgNO3溶液,稀硝酸,KMnO4溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com