
��14�֣��ҹ��Ƽҵ������������°�������1939�귢���������ĺ����Ƽ������ķ�Ӧԭ���������»�ѧ����ʽ��ʾ��
NH3+CO2+NaCl+H2O===NH4Cl+NaHCO3�����壩��
���ݴ�ԭ�������Ƶ�̼�����ƾ��壬ijУѧ�����������ʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���͡�
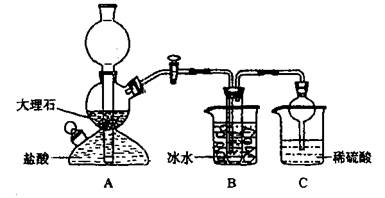
��1��Aװ������������Ӧ�����ӷ���ʽΪ ��
Cװ����ϡ���������Ϊ ��
��2���±������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ��
|
�¶� �ܽ�� �� |
0�� |
10�� |
20�� |
30�� |
40�� |
50�� |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
���ձ������ݣ������Bװ����ʹ�ñ�ˮ��Ŀ���� ��
��3����Уѧ���ڼ�������װ�������Ժ����ʵ�飬���û�еõ�̼�����ƾ��壬ָѰ��ʦָ��Ӧ�� װ��֮�䣨��д��ĸ������һ��ʢ�� ��ϴ��װ�ã��������� ��
��4������Уѧ������ʵ��ʱ�����ñ���ʳ��ˮ�к�NaCl������Ϊ5.85g��ʵ���õ������NaHCO3���������Ϊ5.04g����NaHCO3�IJ���Ϊ ��
 �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| �¶� �ܽ�� �� |
0�� | 10�� | 20�� | 30�� | 40�� | 50�� |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶��ܽ�� | 0�� | 10�� | 20�� | 30�� | 40�� | 50�� |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ����һ�и���9���¿���ѧ�Ծ����������� ���ͣ�ʵ����
��8�֣��ҹ��Ƽҵ������ ��°�������1939�귢���������ĺ����Ƽ������ķ�Ӧԭ���������»�ѧ����ʽ��ʾ��
��°�������1939�귢���������ĺ����Ƽ������ķ�Ӧԭ���������»�ѧ����ʽ��ʾ��
NH3��CO2��NaCl��H2O��NH4Cl��NaHCO3�����壩
���ݴ�ԭ�������Ƶ�̼�����ƾ��壬ijУѧ�����������ʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���͡�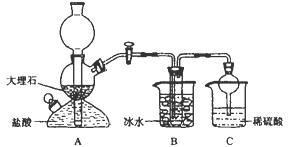
��1��Aװ������������Ӧ�����ӷ���ʽΪ ��
Cװ����ϡ���������Ϊ ��
��2���±������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ��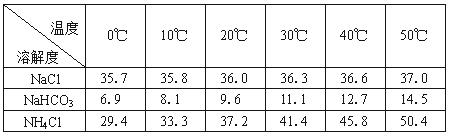
���ձ������ݣ������Bװ����ʹ�ñ�ˮ��Ŀ���� ��
��3����Уѧ���ڼ�������װ�������Ժ����ʵ�飬���û�еõ�̼�����ƾ��壬ָ����ʦָ��Ӧ�� װ��֮�䣨��д��ĸ������һ��ʢ�� ��ϴ��װ�ã��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���¿α���������¿���һ����ѧ�Ծ���A�����������棩 ���ͣ�ʵ����
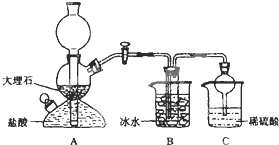
[2012������ʯ��ɽһģ]��10�֣��ҹ��Ƽҵ������ ��°�������1939�귢���������ĺ����Ƽ������ķ�Ӧԭ���������»�ѧ����ʽ��ʾ��
��°�������1939�귢���������ĺ����Ƽ������ķ�Ӧԭ���������»�ѧ����ʽ��ʾ��
NH3��CO2��NaCl��H2O��NH4Cl��NaHCO3�����壩
���ݴ�ԭ�������Ƶ�̼�����ƾ��壬ijУѧ�����������ʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���͡�
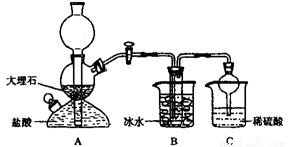
��1��Aװ������������Ӧ�����ӷ���ʽΪ ��
Cװ����ϡ���������Ϊ ��
��2���±������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ��
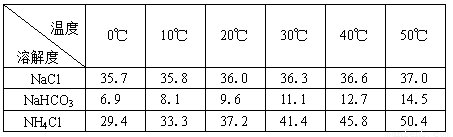
���ձ������ݣ������Bװ����ʹ�ñ�ˮ��Ŀ���� ��
��3����Уѧ���ڼ�������װ�������Ժ����ʵ�飬���û�еõ�̼�����ƾ��壬ָ����ʦָ��Ӧ�� װ��֮�䣨��д��ĸ������һ��ʢ�� ��ϴ��װ�ã��������� ��
��4������Уѧ������ʵ��ʱ�����ñ���ʳ��ˮ�к�NaCl������Ϊ5.85g��ʵ���õ������NaHCO3���������Ϊ5.04g����NaHCO3�IJ���Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com