


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
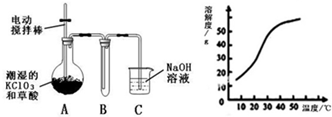 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
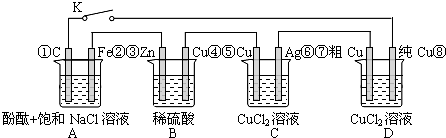
| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电能力增强 |
| B、溶液中c(H+)/c(CH3COOH)增大 |
| C、醋酸的电离程度增大,c(H+)亦增大 |
| D、电离平衡左移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从安全的角度考虑,金属钠着火时,应立即用水将其扑灭 |
| B、氢氧化铁溶胶、乙酸与乙醇的混合液、含PM2.5的大气均为胶体 |
| C、纤维素在人体内可发生水解反应,故可做人类的营养物质 |
| D、石英可用于生产光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com