
【题目】离子液体是一种由离子组成的液体,在低温下也能以液态存在,是一种很有研究价值的溶剂。研究显示最常见的离子液体主要由图示正离子和负离子组成:

回答下列问题:
(1)按电子排布,Al划分在元素周期表中的______区(填“s”“p”“d”或“ds”),图中负离子的空间构型为____________________。
(2)基态Cl原子的价电子排布图为____________________。
(3)图中正离子有令人惊奇的稳定性, 它的电子在其环外结构中高度离域。该正离子中C原子的杂化方式为_________。该化合物中不存在____(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(4)C、N、H三种元素的电负性由大到小的顺序为 __________,NH3与CH4的中心原子均为 sp3杂化,但是H-N-H 的键角小于H-C-H的键角,原因是________。
(5)AlN是一种陶瓷绝缘体,具有较高的导热性和硬度, 其立方晶胞如图所示,Al原子周围紧邻的Al原子有_____个。已知:氮化铝的密度为dg/cm3, 阿伏加德罗常数为NA,则最近的N原子与Al原子间的距离为_____________pm。

【答案】p 正四面体 ![]() sp2、sp3 E N>C>H NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小 12
sp2、sp3 E N>C>H NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小 12 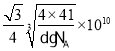
【解析】
(1)按电子排布,根据主族元素中最后排入的电子轨道名称命名其区名称,Al原子最后排入的电子是3p能级上的电子,位于p区;图中负离子中铝离子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为正四面体;故答案为:p;正四面体;
=4且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为正四面体;故答案为:p;正四面体;
(2)基态Cl原子的价电子为最外层电子,电子排布式为3s23p5,则排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(3)环上的C原子价层电子对个数是3、乙基上C原子价层电子对个数是4,根据价层电子对互斥理论判断C原子的杂化方式,前者为sp2后者为sp3杂化;该化合物中阳离子和阴离子间形成离子键,阳离子中的C-H键属于极性键,C-C键属于非极性键,阴离子中存在配位键,没有氢键,故答案为:sp2;sp3;E;
(4)元素的非金属性越强,其电负性越大,电负性大小顺序是N>C>H;NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小, H-N-H 的键角小于H-C-H的键角,故答案为:N>C>H;NH3中N原子有一个孤电子对,孤电子对与成键电子间斥力更大,键角更小;
(5)根据晶胞的结构分析,以上底面面心的Al为参考点,周围与距离最近的Al有12个,取1mol晶胞,即有NA个晶胞,1个晶胞中Al原子数目为:8×![]() +6×
+6×![]() =4,N原子数目为4,设晶胞的棱长为xcm,则x3d=
=4,N原子数目为4,设晶胞的棱长为xcm,则x3d=![]() ,则x=
,则x=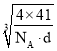 cm,则最近的N原子与Al原子间的距离为
cm,则最近的N原子与Al原子间的距离为![]() x=
x=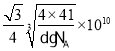 pm,故答案为:12;
pm,故答案为:12;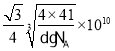 。
。


科目:高中化学 来源: 题型:
【题目】已知:将![]() 溶液用
溶液用![]() 盐酸滴定时,若用酚酞做指示剂,终点时消耗盐酸
盐酸滴定时,若用酚酞做指示剂,终点时消耗盐酸![]() ;若用甲基橙做指示剂,终点时消耗盐酸
;若用甲基橙做指示剂,终点时消耗盐酸![]() 。现有一份白色粉末,可能含有
。现有一份白色粉末,可能含有![]() 、
、![]() 、
、![]() 的一种或两种。现取一定量的该粉未配成适当浓度的稀溶液并分成两等份,分别用
的一种或两种。现取一定量的该粉未配成适当浓度的稀溶液并分成两等份,分别用![]() 盐酸滴定。一份用酚酞做指示剂,消耗盐酸
盐酸滴定。一份用酚酞做指示剂,消耗盐酸![]() ;另一份用甲基橙做指示剂,消耗盐酸
;另一份用甲基橙做指示剂,消耗盐酸![]() 。下列说法正确的是( )
。下列说法正确的是( )
①若![]() ,则固体中只含有
,则固体中只含有![]()
②若![]() ,则固体中只含
,则固体中只含![]()
③若![]() ,则固体中含有
,则固体中含有![]() 、
、![]()
④若![]() ,则固体中含有
,则固体中含有![]() 、
、![]()
A.①②③④B.③④C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示:
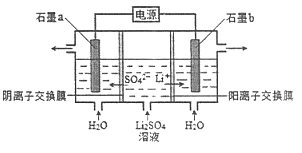
下列叙述不正确的是
A.b极附近溶液的pH增大
B.a极发生的反应为2H2O-4e-=O2↑+4H+
C.该法制备LiOH还可得到硫酸和氢气等产品
D.b极是电解池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
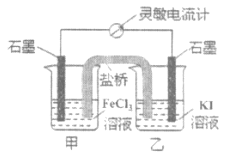
A.反应开始时,乙中电极反应为2I--2e-=I2
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.平衡时甲中溶入FeCl2固体后,电流计指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸加热制取乙烯,实验装置如图,制备过程中,常会看到烧瓶中液体变黑,并有刺激性气味气体(SO2)产生。
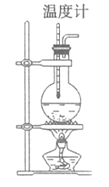
(1)制备乙烯的化学方程式_________。
(2)加热至140℃时发生副反应,写出该反应有机产物的结构简式__________,该反应的反应类型为:__________。
(3)写出产生SO2的化学方程式:___________。
(4)图中一处明显的错误是__________,加入碎瓷片的作用是__________。
(5)有人设计下列实验以确认上述混合气体中有乙烯和SO2。装置①、②、③、④可盛放的试剂是①__________;②__________;③品红;④__________。(填字母)

A. 品红溶液 B. NaOH溶液 C. 浓H2SO4 D. 酸性KMnO4溶液
(6)实验(5)中确认含有乙烯的现象是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,有关合成路线图如下:
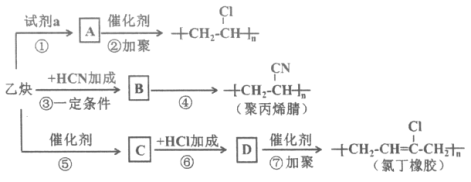
已知: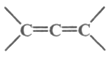 不稳定
不稳定
(1)乙炔中官能团的名称是__________。
(2)试剂a是__________。
(3)写出物质B的结构简式__________。
(4)④的反应类型是__________。
(5)写出下列反应的化学方程式:反应⑤_______;反应⑦_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国Lawrece Liermore国家实验室(LINL)成功地在高压下将![]() 转化为具有类似
转化为具有类似![]() 结构的原子晶体,下列关于
结构的原子晶体,下列关于![]() 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A. ![]() 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B. 在一定条件下,![]() 原子晶体转化为
原子晶体转化为![]() 分子晶体是物理变化
分子晶体是物理变化
C. ![]() 的原子晶体和
的原子晶体和![]() 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D. 在![]() 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com