
铋(Bi) 位于元素周期表中第ⅤA族,其价态为+3价时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应实验现象如表所示:
位于元素周期表中第ⅤA族,其价态为+3价时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应实验现象如表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI?淀粉溶液 |
实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:实验题
综合利用 海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
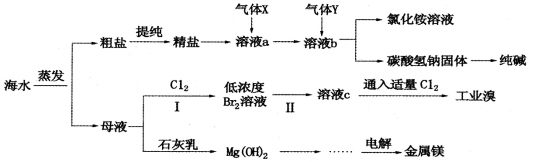
(1)利用海水可制备C12,为便于储存,可将C12液化,应采取的措施之一是__________。
(2)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解 ②加过量的BaCl2溶液 ③加过量的NaOH溶液 ④加过量的Na2CO3溶液 ⑤_________(填操作名称,下同) ⑥加适量的盐酸 ⑦___________。
(3)气体X为___________。溶液b中发生反应的化学方程式是______________________。
(4)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_________________。步骤Ⅱ中通入空 气吹出Br2,用SO2水溶液进行吸收,得到溶液c,反应的离子方程式为__________________。在实验室中,从工业溴中提取溴单质的实验操作名称是____________。
气吹出Br2,用SO2水溶液进行吸收,得到溶液c,反应的离子方程式为__________________。在实验室中,从工业溴中提取溴单质的实验操作名称是____________。
(5)工业上制取金属镁的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:实验题
硫代硫酸钠(Na2S2O3)又名大苏打、海波,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。实验室常以硫化钠(Na2S)为原料制取Na2S2O3。
实验项目I:工业级硫化钠的纯化。
本实验对Na2S的纯度要求较高,利用图1所示的装置将工业级 的Na2S提纯。
的Na2S提纯。


图1 图2
已知:Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。
提纯步骤依次为:
① 将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
② 按图1所示连接仪器,水浴加热;
冷凝管的作用是 。
向冷凝管中通入冷却水的方向是从 口进水(填“a”或“b”)。
③ 待烧瓶中固体不再减少时,停止加热,将烧瓶取下,趁热过滤,除去不溶物;
 ④ 将滤液转移至烧杯中,冷却结晶,过滤;
④ 将滤液转移至烧杯中,冷却结晶,过滤;
⑤ 将所得固体用少量 (填试剂名称)洗涤,干燥后得到Na2S·9H2O晶体。
实验项目II:硫代硫酸钠的制备。
制备步骤依次为:
① 称取一定质量的硫化钠晶体和碳酸钠固体,溶于水,转移至三颈瓶中;
② 按图2所示连接仪器,并在各仪器中加入相应的试剂,打开分液漏斗的活塞,使反应生成的气体较均匀地通入三颈瓶中,并用电磁搅拌器不断搅拌;
仪器A的名称为 。
写出三颈瓶中发生的反应的化学方程式: 。
③ 随着气体的通入,逐渐有浅黄色的硫析出,继续通入气体至溶液pH接近7,停止通入气体,取下三颈烧瓶,过滤;
实验过程中若未及时停止通入气体可能产生的后果为 。
④ 将滤液置于蒸发皿中加热,待 时,停止加热,冷却,过滤,即得Na2S2O3·5H2O晶体。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(NH4+)随反应进行逐渐减小。下列判断正确的是( )
A.反应的还原产物是N2  B.消耗1 mol氧化剂,转移电子3 mol
B.消耗1 mol氧化剂,转移电子3 mol
C.氧化剂与还原剂的物质的量之比为2:3 D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源:2017届江西省、兴国三中等四校高三上第一次联考化学卷(解析版) 题型:实验题
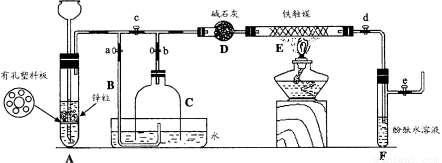
为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气, 待无底细口瓶C内水位下降到液面保持不
待无底细口瓶C内水位下降到液面保持不 变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省、兴国三中等四校高三上第一次联考化学卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
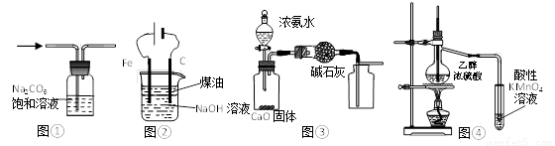
A.图①除去CO2中的HCl
B.图②装置制备Fe(OH)2并能较长时间观察其颜色
C.图③所示装置制取并收集干燥纯净的NH3
D.图④证明CH3CH2OH发生消去反应生成了乙烯
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:填空题
钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图所示:
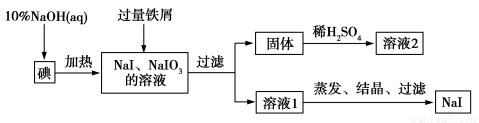
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO 与IO-的物质的量之比为1∶1,则该反应的离子方程式为 。
与IO-的物质的量之比为1∶1,则该反应的离子方程式为 。
(2)生产流程中加入过量铁屑的目的是__________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是__________________。
(3)溶液2中除含有H+外,一定含有的阳离子是_______________;试设计实验证实该金属阳离子的存在:___________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法 对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,根据信息写出过程I发生的化学方程式:____________ ______。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式:______________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高一上期中化学试卷(解析版) 题型:选择题
从海水中可以提取溴,主要反应为2Br-+Cl2=2Cl-+Br2,下列说法正确的是
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com