
【题目】(题文)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写下列空白:
(1)步骤③和⑤的实验操作名称分别是________________、____________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是________,该装置的操作名称为__________。
(3)步骤④反应的离子方程式是___________________________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:______。
【答案】过滤 萃取(分液)C蒸馏2I-+H2O2+2H+===I2+2H2O取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无
【解析】
(1)步骤③是分离固体和液体,则实验操作为过滤,步骤⑤是将碘单质从碘水中分离出来,实验操作为萃取分液;
(2)步骤⑥是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,A~D分别是过量、蒸发、蒸馏、分液,因此答案选C;
(3)碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O;
(4)由于淀粉遇碘单质会变蓝,故取少量溶液于试管中,滴加少量淀粉溶液,若溶液变蓝,说明原溶液中含有单质碘,反之则无。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_________。和O同一周期且元素的第一电离能比O大的有______(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)H2O分子中O原子的价层电子对数是________,CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为_______。
(3)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为_________,原因是__________。
(4)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(5)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
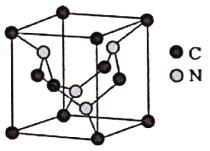
①该晶体硬度超过金刚石的原因是____________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
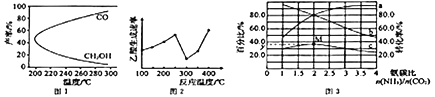
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)=- 2C(g)+ 2D(g),2 分钟末反应达到平衡状态,生成了0.6mol D,回答下列问题:
(1)用D表示2min内的平均反应速率为____________,A的转化率为_____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度_________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____________mol B 物质。
(4)若向原平衡体系中再投入1molA和1molB,B的转化率_________(填“增大”、“减少”或“不变”)。
II.有人设计出利用CH3OH 和O2的反应,用铂电极在KOH 溶液中构成原电池。电池的总反应类似于CH3OH 在O2中燃烧,则:
(1)每消耗1molCH3OH 可以向外电路提供___________mole-;
(2)负极电极反应式为________________________。
(3)电池放电后,溶液的pH_________(填“增大”、“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验。
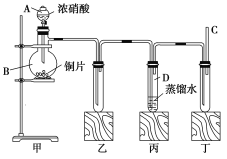
回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是_____,该装置中发生反应的化学方程式为___。
(2)实验过程中,装置乙、丙中出现的现象分别是__________、____________;装置丙中的试管内发生反应的离子方程式为________________(不是离子反应的不写)。
(3)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再向溶液中滴加KSCN溶液,溶液变为________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
A. 新平衡体系中,SO2和O2物质的量之比仍为2∶1
B. 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小
C. 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大
D. 若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com