
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
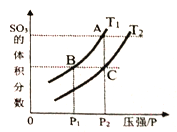
【答案】 PCl5(g) ![]() PCl3(g)+Cl2(g) ΔH=+93kJ/mol ΔH1<0 CO的平衡转化率为75% C T12 该反应是放热反应,温度低,有利于平衡往正方向移动,图象中,等压条件下,T1的SO3体积分数大于T2的SO3体积分数。所以T12 (2分)。 增大体系压强,使用催化剂
PCl3(g)+Cl2(g) ΔH=+93kJ/mol ΔH1<0 CO的平衡转化率为75% C T12 该反应是放热反应,温度低,有利于平衡往正方向移动,图象中,等压条件下,T1的SO3体积分数大于T2的SO3体积分数。所以T12 (2分)。 增大体系压强,使用催化剂
【解析】⑴.①. 2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
②2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
由盖斯定律可知(①②)÷2得到PCl5(g)═PCl3(g)+Cl2(g) 则△H=+93kJ/mol,故答案为:PCl5(g)═PCl3(g)+Cl2(g) 则△H=+93kJ/mol;
⑵.由表中数据可知,温度越高,K越小,说明升高温度,平衡逆向移动,则正反应为放热反应,△H1<0;
根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,
参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=0.015mol/L÷(0.005mol/L+0.015mol/L)×100%=75%,
故答案为:ΔH1<0;CO的平衡转化率为75%;
⑶. A、可逆反应到达平衡时SO2和SO3浓度不一定相等,与二氧化硫的起始浓度以及转化率有关,故A错误;
B、密闭容器中体积恒定,质量守恒,所以混合气体的密度始终不变,不能判断平衡状态,故B错误;
C、在一定体积的绝热密闭容器中,随着反应的进行,容器内的温度一直在改变,则温度不变时,说明反应达到了平衡状态,故C正确;
D、SO3的生成速率与SO2的消耗速率都表示正反应速率,不能说明达到平衡状态,故D错误;
该反应是放热反应,升高温度平衡逆向移动,SO3的体积分数减小,即温度越高,SO3的体积分数越小,所以T1<T2;根据影响反应速率的因素,如果要加快正反应的速率,除了改变温度,还可以用增大压强、使用催化剂的方法;
故答案为:C;T1<T2;该反应是放热反应,温度低,有利于平衡往正方向移动,图象中,等压条件下,T1的SO3体积分数大于T2的SO3体积分数。所以T1<T2 ;增大体系压强,使用催化剂。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,将A逐滴加入B中。
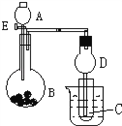
a.若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的离子方程式__________;然后往烧杯中加入沸水,可观察到试管C中的现象_______;
b.若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入3滴乙醛,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_____________(填名称),C是_______(填化学式).与乙醛溶液混合后,该溶液中反应的化学方程式________;仪器D在此实验中的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是
A.可利用电渗析法淡化海水
B.硅胶常用作催化剂的载体和干燥剂
C.冬奥会速滑服所用的材料聚氨酯属于新型无机非金属材料
D.75%的酒精、高温、紫外线能够杀灭新型冠状病毒的原因都是使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ. 配制50mL1.0mol/LFeBr2溶液;
ⅱ. 上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液常加少量HBr是为了_____________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_____________________。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上层清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为:![]() ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )
①银镜反应 ②被新制的氢氧化铜氧化 ③1mol该有机物在一定条件下和2mol氢气发生加成反应 ④能使溴水褪色 ⑤能形成高聚物 ⑥被酸性KMnO4溶液氧化.
A. ①③④⑤ B. ②③④⑥ C. ①③⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19.在它们的化合物中,主要化合价均不止一种,但有一种相同的化合价.它们的部分性质如下:
元素 | A | B | C | D |
原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
最高正化合价 | ﹣4 | +4 |
(1)A元素在元素周期表中的位置为 .
(2)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为 .
(3)B的单质与D的最高价氧化物对应的水化物在加热条件下发生反应的化学方程式为 .
(4)C单质与Al具有某些相似性,比如能与强碱反应,写出C单质与NaOH溶液反应的化学方程式: .
(5)A、B、C、D均可形成分子中含18电子的氢化物,这些氢化物的分子式分别为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,现榨的苹果汁在空气中放置一会儿会 由淡绿色(Fe2+ )变为黄色(Fe3+)。若榨汁时加人维生素C,可有效防止这种现象发生,这说明维生素C具有
A.还原性B.碱性C.氧化性D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀层铂粉(铂粉吸附气体的能力强,性质稳定),请回答下列问题:
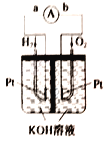
(1)该装置能量转化的主要形式是_________。
(2)在导线中电子流动方向为_________(用a、b表示)。
(3)负极反应式为_________ 。
(4)电极表面镀铂粉的目的:_________。
(5)若将该电池中的KOH溶液换为稀硫酸,内电路溶液中H+向_________ (填“正极”或“负极”)移动,电池工作时正极的反应式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com