
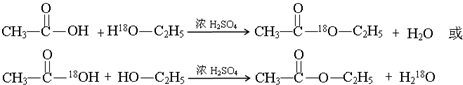
 ;
;
分析 (1)浓硫酸具有酸性,能够与醋酸钠反应生成乙酸,乙酸、乙醇在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯,据此解答;
酯化反应原理为:酸去羟基、醇去氢,据此书写方程式;
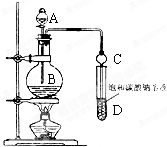
(2)乙酸、乙醇易溶于碳酸钠溶液,会导致装置内气体减小,容易发生倒吸;碳酸钠为强碱弱酸盐,水解生成碳酸氢根离子和氢氧根离子;乙酸乙酯密度小于水,难溶于水,碳酸钠溶液显碱性,遇到酚酞变红;
解答 (1)浓硫酸具有酸性,能够与醋酸钠反应生成乙酸,可以用浓硫酸制备乙酸,乙酸、乙醇在浓硫酸做催化剂、吸水剂条件下反应生成乙酸乙酯;
酯化反应原理为:酸去羟基、醇去氢,乙酸与乙醇发生酯化反应的方程式: ;
;
故答案为:制醋酸、催化剂、吸水剂; ;
;
(2)乙酸、乙醇易溶于碳酸钠溶液,会导致装置内气体减小,容易发生倒吸,球形干燥管还可以防止倒吸,同时球形干燥管兼有冷凝蒸汽的作用;碳酸钠为强碱弱酸盐,水解生成碳酸氢根离子和氢氧根离子,离子方程式:CO32-+H2O?HCO3-+OH-;乙酸乙酯密度小于水,难溶于水,碳酸钠溶液显碱性,遇到酚酞变红,所以会看到现象为:溶液分层,上层无色油状液体,下层溶液颜色变浅;
故答案为:防止倒吸兼冷凝;CO32-+H2O?HCO3-+OH-;溶液分层,上层无色油状液体,下层溶液颜色变浅.
点评 本题考查了乙酸乙酯的制备,题目难度不大,涉及浓硫酸、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g甲烷所含原子数为4NA | |
| B. | 标准状况下,2.24LCH4和NH3混合气气体中含有的电子数目为NA | |
| C. | 标准状况下,11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| D. | 常温下,5.6克铁与足量的盐酸反应,失去的电子数为0.2mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
若m g氧气含n个氧气分子,则阿伏伽德罗常数为
A.2n B.16n/m C.n D.32n/m
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
甲容器进行A→ B的反应,ΔH<0,反应速率为v1,在t1温度下进行;乙容器进行C→D的反应,ΔH>0,反应速率为v2,在t2温度下进行。对于上述反应,下列说法正确的是
A.若t1 > t2,则v1>v2
B.甲容器内每分钟减少4mol A,乙容器内每分钟减少2mol C,则甲容器内的反应速率比乙容器内的反应速率快
C.当温度升高时v1增大,v2减小
D.在甲、乙容器中分别加入MnO2,v1、v2不一定加快
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
下列有关的判断或表示方法正确的是
A.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1
B.中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验。
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:| 化合物 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 溶解度(g)/(100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 乙酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 相对分子 质量 | 熔点 /℃ | 沸点 /℃ | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | |||||
| CH3COOH | 60 | 16.6 | 117.9 | 1.05 | 互溶 | 互溶 | 互溶 |
| C2H5OH | 46 | -117.3 | 78.5 | 0.8 | 互溶 | / | 互溶 |
| CH3COOC2H5 | 88 | -83.58 | 77.1 | 0.9 | 可溶 | 互溶 | 互溶 |
| C2H5OC2H5 | 74 | -116.2 | 34.51 | 0.7 | 可溶 | 互溶 | / |
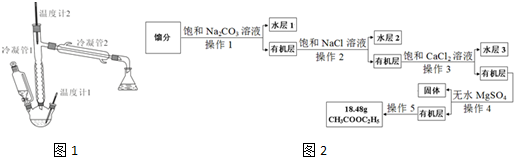
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com